Betegtájékoztató
1. Milyen típusú gyógyszer a Feiba NF és milyen betegségek esetén alkalmazható?
A Feiba NF egy emberi plazmából előállított készítmény, amely elősegíti a véralvadást, amikor egyes véralvadási faktorok ellen termelt ellenanyagok gátolják a saját vagy beadott faktor aktivitását.
A Feiba NF-et vérzés kezelésére vagy megelőzésére alkalmazzák VIII. faktor elleni ellenanyaggal rendelkező A típusú hemofíliás (vérzékeny) betegeknél.
A Feiba NF-et vérzés kezelésére vagy megelőzésére alkalmazzák IX. faktor elleni ellenanyaggal rendelkező B típusú hemofíliás betegeknél.
Továbbá a Feiba NF-et vérzés kezelésére vagy megelőzésére alkalmazzák olyan nem hemofíliás betegeknél, akiknél a VIII., XI. és XII. faktorok ellen ellenanyag (inhibitor) fejlődött ki.
A Feiba NF-et egyedi esetekben, olyan betegek kezelésére is használták, akiknél szerzett (nem veleszületett) X. és XIII. alvadási faktor elleni ellenanyag volt a szervezetükben.
A Feiba NF-et alkalmazzák VIII. faktorkoncentrátummal kombinációban is hosszú távú kezelésre, amellyel a VIII. faktor elleni ellenanyag teljesen és véglegesen eltávolítható a vérplazmából, majd ezt követően az ellenanyagmentes betegekhez hasonló módon, rendszeresen adható VIII. faktorkoncentrátum.
2. Tudnivalók a Feiba NF alkalmazása előtt
Kérjük, értesítse kezelőorvosát, amennyiben valamire allergiás.
Kérjük, értesítse kezelőorvosát, amennyiben alacsony nátriumtartalmú diétán van.
Ne alkalmazza a Feiba NF-et
A következő körülmények között csak abban az esetben adható Feiba NF, ha - pl. rendkívül magas ellenanyagszint, életet veszélyeztető vérzés vagy vérzés veszélye (sérülés vagy műtét utáni vérzés) miatt - a megfelelő alvadási faktorkoncentrátum adása minden bizonnyal hatástalan lesz:
- ha allergiás (túlérzékeny) a VIII. koagulációs faktor ellenanyagot megkerülő aktivitású faktorkomplexre vagy a Feiba NF egyéb összetevőjére.
- ha disszeminált intravaszkuláris koagulációja van (DIC, konszumpciós koagulopátia, egy életet veszélyeztető állapot a nagymértékű véralvadás miatt kifejezett alvadással a vérereken belül. Ez a véralvadási faktorok teljes felhasználódásához vezet.).
- májkárosodás laboratóriumi és/vagy klinikai tünetei észlelhető; a májműködés beszűkülése esetén az aktivált alvadási faktorok lassú eliminációja miatt fokozott a DIC kialakulásának kockázata.
- szívkoszorúér (koronária)-betegség, heveny trombózis és/vagy embólia esetén kizárólag életveszélyes vérzések elhárítása érdekében javallt a Feiba NF alkalmazása.
Figyelmeztetések és óvintézkedések
A FEIBA NF alkalmazása előtt beszéljen kezelőorvosával, mivel a kezelés során, mint minden vénába adott plazmakészítmény esetén, allergiás (túlérzékenységi) reakció léphet fel. Annak érdekében, hogy az allergiás reakciót minél előbb észlelje, ismernie kell a túlérzékenységi reakció alábbi lehetséges korai tüneteit:
- bőrpír
- bőrkiütés
- csalánkiütés (urtikária)
- viszketés
- a szemhéjak, az ajkak és a nyelv vagy garat duzzanata (angioödéma)
- nehézlégzés
- mellkasi nyomásérzés
- gyengeség
- szédülés
- hirtelen vérnyomásesés
A vérplazmából előállított gyógyszerkészítmények allergiás reakcióinak egyéb tünetei, köztük a letargia és nyugtalanság is előfordulhatnak.
Ha a fenti tünetek közül bármelyik jelentkezik Önnél, azonnal állítsa le az infúziót és értesítse kezelőorvosát. A felsorolt tünetek az anafilaxiás sokk (az egész szervezetet érintő súlyos allergiás reakció légzés- és keringészavarral) korai jelei lehetnek. A súlyos tünetek azonnali ellátást igényelnek.
A kezelőorvos olyan betegnél, akinél a készítmény hatóanyagával vagy bármely összetevőjével szemben allergia (túlérzékenység) gyanítható, csak akkor fogja a Feiba NF-et ismételten alkalmazni, miután gondosan mérlegelte a kezelésből származó várható előnyt és az ismételt adagolás veszélyét, figyelembe véve más gyógyító és/vagy megelőző kezelés hatástalanságát vagy az egyéb lehetséges alternatív terápiás tényezőket.
- Amennyiben a vérnyomás vagy pulzusszám jelentős változását, légzési nehézséget, köhögést, vagy mellkasi fájdalmat érzékel, azonnal állítsa le az infúziót és értesítse kezelőorvosát. Kezelőorvosa elvégzi a megfelelő vizsgálati és kezelési lépéseket.
- Feiba NF kezelés során a vérzésre való hajlam és a vérrögképződés (trombózis) kockázata egy időben lehet fokozott az ellenanyaggal rendelkező (inhibitoros) hemofíliás betegeknél, illetve azoknál a betegeknél, akiknél szerzett (nem öröklött állapot) a véralvadási faktorokat gátló ellenanyagok jelenléte.
A Feiba NF alkalmazása során előfordulhatnak vérrögök okozta (tromboembóliás) események, beleértve a disszeminált intravaszkuláris koagulációt (DIC), a vénás trombózist, tüdőembóliát, szívinfarktust és szélütést (agyérkatasztrófa = sztrók). Néhány tromboembóliás esemény nagy dózisú Feiba NF-kezelés során fordult elő. Rekombináns aktivált VII. faktor egyidejű alkalmazása megnövelheti a tromboembóliás események kialakulásának veszélyét.
A kiserek trombotikus károsodásának (trombotikus mikroangiopátia) eseteit jelentették egy emicizumabbal végzett klinikai vizsgálatból, ahol a vizsgálati alanyok áttöréses vérzését Feiba NF-fel kezelték.
Az emberi vérből vagy plazmából előállított gyógyszerkészítmények okozta fertőzések megelőzésére szolgáló szokásos óvintézkedések közé tartoznak a donorok gondos válogatása, a fertőzések átvitelének kockázatát hordozó egyének kiszűrésére, az egyedi vérminták és a plazmakészletek szűrése bizonyos vírus- és fertőzésmarkerekre. A gyártók a vírusok inaktiválására/eltávolítására szolgáló hatékony lépéseket iktatnak be a vér- és plazmakészítmények gyártási folyamatába. Mindezek ellenére, az emberi vérből vagy plazmából készült gyógyszerkészítmények alkalmazása esetén nem zárható ki teljes biztonsággal a fertőző ágensek átvitele. Ugyanez érvényes az ismeretlen és új vírusokra vagy más kórokozókra.
Az alkalmazott módszerek hatékonynak bizonyultak bizonyos burokkal rendelkező vírusok ellen, úgymint HIV (AIDS-betegséget okozó vírus), hepatitisz B és hepatitisz C vírus (májgyulladást okozó vírusok), valamint a burokkal nem rendelkező hepatitisz A vírus ellen. Ezek az eljárások korlátozott hatékonysággal rendelkezhetnek bizonyos burok nélküli vírusokkal szemben, mint pl. a parvovírus B19. A parvovírus B19-fertőzés leginkább a terhes nőkre (magzati fertőzés miatt), és azokra a betegekre veszélyes, akik immunhiányban vagy a vérszegénység (anémia) bizonyos típusaiban (pl. sarlósejtes betegség vagy hemolitikus anémia) szenvednek.
A vérplazmából előállított alvadási faktorkészítményekkel ismételten vagy rendszeresen kezelt betegeket ajánlott megfelelő (hepatitisz A és B elleni) védőoltásban részesíteni. Nagydózisú Feiba NF alkalmazása után, a passzívan átvitt hepatitis B felületi antitestek átmeneti emelkedése a szerológiai tesztek kóros pozitív eredményét okozhatja.
Mivel a Feiba NF vércsoport-izohemagglutinineket tartalmaz, a vörösvértest-antitestek passzív átvitele félrevezető eredményeket okozhat a szerológiai vizsgálatok során.
Amikor Feiba NF-et kap, kifejezetten ajánlott a beadott Feiba NF készítmény nevét és gyártási tételszámát feljegyezni annak érdekében, hogy nyomon követhető legyen az alkalmazott készítmények és a beteg közötti kapcsolat.
Egyéb gyógyszerek és a Feiba NF
Feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg vagy nemrégiben szedett egyéb gyógyszereiről, beleértve a vény nélkül kapható készítményeket is.
Nem végeztek megfelelő és jól kontrollált vizsgálatokat a Feiba NF és a rekombináns aktivált VII-es faktor, alvadékoldást gátló szerek (antifibrinolitikumok) vagy emicizumab együttes, vagy egymást követő alkalmazására. Számításba kell venni tromboembóliás események kialakulásának lehetőségét, amennyiben szisztémás alvadékoldást gátló gyógyszereket, úgymint tranexámsavat vagy aminokapronsavat adagolnak Feiba NF alkalmazásával egyidejűleg. Ezért az antifibrinolitikumokat legalább 6-12 órás időkülönbséggel kell beadni a Feiba NF alkalmazásának időpontjához képest.
Kísérleti adatok és klinikai megfigyelések alapján a rekombináns aktivált VII. faktorral történő együttes adagolása esetén, a gyógyszerek közötti kölcsönhatások és ennek eredményeképpen tromboembóliás események előfordulásának lehetősége nem zárható ki.
Szoros orvosi felügyelet szükséges Önnél, amennyiben Feiba NF-kezelés merül fel, miután emicizumabot kapott.
Ahogy semmilyen véralvadási faktort, a Feiba NF-et sem szabad egyéb gyógyszerekkel keverni az alkalmazást megelőzően, mivel ez a készítmény hatásosságának és biztonságosságának csökkenését okozhatja. Javasolt a közös vénás bemenetet élettani (fiziológiás) sóoldattal átöblíteni a Feiba NF beadása előtt és után.
Terhesség, szoptatás és termékenység
Mielőtt bármilyen gyógyszert elkezdene szedni, beszélje meg kezelőorvosával vagy gyógyszerészével.
Kezelőorvosa fogja eldönteni, hogy a Feiba NF alkalmazható-e a terhesség és szoptatás ideje alatt. Terhesség során a vérrögképződés megnövekedett veszélye miatt a Feiba NF-et kizárólag szigorú orvosi felügyelet mellett és kizárólag akkor lehet alkalmazni, ha valóban szükséges.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
Nem észlelték, hogy a Feiba NF befolyásolná ezeket a képességeket.
A Feiba NF nátriumot tartalmaz
500 Egység
Ez a gyógyszer hozzávetőlegesen 40 mg nátriumot tartalmaz injekciós üvegenként, ami felnőtteknél megfelel a javasolt napi maximális nátriumbevitel 2%-ának.
1000 Egység
Ez a gyógyszer hozzávetőlegesen 80 mg nátriumot tartalmaz injekciós üvegenként, ami felnőtteknél megfelel a javasolt napi maximális nátriumbevitel 4%-ának.
3. Hogyan kell alkalmazni a Feiba NF-et?
A Feiba NF fagyasztva szárított port a mellékelt oldószerrel oldja fel és vénán keresztül adja be.
A Feiba NF-et mindig pontosan az orvos utasításainak megfelelően alkalmazza. Ha valamiben nem biztos, kérdezze meg kezelőorvosát vagy gyógyszerészét.
A készítmény adagolását és az adagolási időközöket kezelőorvosa az Ön egyéni igényei szerint határozza meg, figyelembe véve a véralvadási zavar súlyosságát, a vérzés helyét és mértékét, az Ön általános állapotát, valamint a kezelésre adott válaszát. Ne változtassa meg, illetve önállóan ne hagyja abba az orvos által meghatározott adagolást.
Beszéljen kezelőorvosával vagy gyógyszerészével, ha az a benyomása, hogy a Feiba NF hatása túl erős vagy túl gyenge.
Alkalmazás előtt melegítse a készítményt szobahőmérsékletűre vagy testhőmérsékletűre, ha szükséges.
A Feiba NF-et kizárólag közvetlenül beadás előtt szabad feloldani. Az elkészített oldatot haladéktalanul fel kell használni (a készítmény tartósítószert nem tartalmaz).
Finom mozdulatokkal mozgassa körbe-körbe, amíg a por teljesen feloldódik. Győződjön meg róla, hogy a Feiba NF teljesen feloldódott, máskülönben kevesebb Feiba NF Egység jut keresztül a szűrőn.
A zavaros vagy üledékes oldatot az előírásoknak megfelelően meg kell semmisíteni. A felbontott készítményt ne használja újra.
Az oldat elkészítéséhez kizárólag a mellékelt oldószert (injekcióhoz való víz) és eszközöket használja. Amennyiben a Feiba NF alkalmazásához nem a mellékelt eszközöket használja, biztosítsa a megfelelő, legalább 149 mikrométer pórusméretű szűrő használatát.
Ne használja fel a készítményt, ha steril védelme, csomagolása sérült vagy a rongálódás bármely jele látszódik rajta.
Jegyezze fel a készítmény alkalmazását a mellékelt öntapadós címke segítségével.
Bármilyen fel nem használt készítmény, illetve hulladékanyag megsemmisítését a helyi előírások szerint kell végrehajtani.
Az oldatot a következőképpen kell elkészíteni:
Az oldat elkészítése során használjon aszeptikus technikát.
1. Melegítse a felbontatlan oldószeres (steril injekcióhoz való vizet tartalmazó) injekciós üveget szobahőmérsékletre (15 °C - 25 °C), pl. néhány percre steril vízfürdőbe helyezve (legfeljebb 37 °C), ha szükséges.
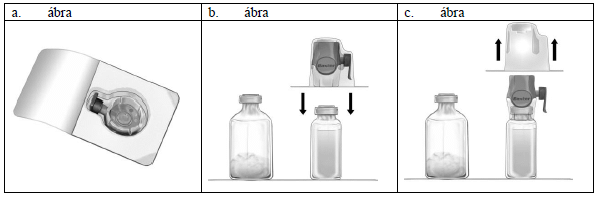
2. Távolítsa el a Feiba NF-et tartalmazó és az oldószeres injekciós üveg zárókupakját és tisztítsa meg mindkettő gumidugóját. Helyezze az injekciós üvegeket egy sima felületre.
3. Bontsa fel a Baxject II Hi-Flow eszköz csomagolását. Úgy húzza le a papírfedelet, hogy ne nyúljon a belsejébe (a. ábra). Még ne vegye ki az eszközt a csomagból.
4. Fordítsa meg a csomagot és szúrja be az átlátszó műanyag tűt az oldószeres injekciós üveg dugójába (b. ábra). Most húzza le a pereménél fogva a csomagolást a Baxject II Hi-Flow eszközről (c. ábra). Ne vegye le a kék sapkát a Baxject II Hi-Flow eszközről.
5. Fordítsa meg az összeillesztett Baxject II Hi-Flow eszközt és oldószeres injekciós üveget úgy, hogy az oldószeres injekciós üveg felülre kerüljön. Szúrja be a lila műanyag tűt a Feiba NF injekciós üveg dugójába. A kialakult vákuum miatt az oldószer átfolyik a Feiba NF injekciós üvegbe (d. ábra).
6. Finom mozdulatokkal mozgassa körbe-körbe, de ne rázza az injekciós üveget, amíg a por feloldódik. Ellenőrizze, hogy a por teljesen feloldódott, máskülönben a készülék szűrője nem engedi át a hatóanyagot.
Az injekció/infúzió beadása:
Az egész folyamat során használjon aszeptikus technikát.
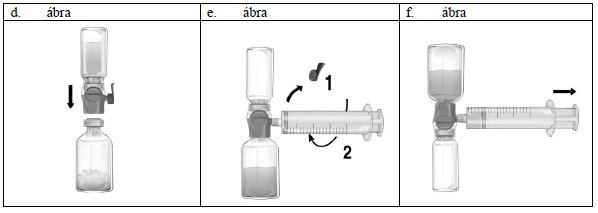
1. Távolítsa el a Baxject II Hi-Flow kék sapkáját. Fogja meg a fecskendőt és szorosan csatlakoztassa a Baxject II Hi-Flow eszközhöz. (Ne szívjon levegőt a fecskendőbe!) (e. ábra) Annak érdekében, hogy a fecskendő és a Baxject II Hi-Flow eszköz közötti szoros kapcsolat biztosítva legyen, kifejezetten ajánlott a luer lock fecskendő használata. (Csatlakoztatás során csavarja a fecskendőt az óramutató járásával egyező irányba ütközésig.)
2. Fordítsa meg az összeillesztett rendszert úgy, hogy a feloldott készítmény legyen felül. Szívja a Feiba NF oldatot a fecskendőbe a dugattyú LASSÚ hátrahúzásával és győződjön meg róla, hogy a Baxject II Hi-Flow eszköz és a fecskendő közötti szoros illeszkedés a szívás teljes ideje alatt fennáll. (f. ábra).
3. Vegye le a fecskendőt.
4. Amennyiben hab képződik a fecskendőben, várjon, amíg az összeesik. Adja be lassan intravénásan az oldatot a szárnyas injekciós készlet (vagy az egyszer használatos tű) segítségével.
A Feiba NF injekció/infúzió legfeljebb 2 Egység/ttkg/perc sebességgel adható be!
Ha az előírtnál több Feiba NF-et alkalmazott
Azonnal értesítse kezelőorvosát. A Feiba NF túladagolása fokozza a nemkívánatos események kockázatát, úgymint vérrögképződés a vérerekben (tromboembólia), konszumpciós koagulopátia (DIC) vagy szívinfarktus.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
Ha bármely mellékhatás súlyossá válik, vagy ha a betegtájékoztatóban felsorolt mellékhatásokon kívül egyéb tünetet észlel, kérjük, értesítse kezelőorvosát vagy gyógyszerészét.
Klinikai vizsgálatokban az alábbi gyakori (10 beteg közül legfeljebb 1-et érinthetnek) mellékhatásokat jelentették:
- túlérzékenységi reakciók
- fejfájás
- szédülés
- alacsony vérnyomás (hipotenzió)
- kiütés
- hepatitisz B felületi antitest pozitivitás
A következő nem ismert gyakoriságú (a rendelkezésre álló adatokból a gyakoriság nem állapítható meg) mellékhatásokat a készítmény forgalomba hozatala után jelentették:
- az egész szervezetet érintő véralvadási zavar (disszeminált intravaszkuláris koaguláció, DIC), ellenanyagszint-növekedés;
- súlyos allergiás reakció (anafilaxiás reakció), jellemző tünetei: hirtelen kialakuló szöveti duzzanat leggyakrabban az arc, száj, nyelv, torok érintettségével, ez légzési nehezítettséget is okozhat, de a test bármely területén jelentkezhet, bőrkiütés, gyengeség, ájulásérzés, vérnyomásesés, eszméletvesztés. csalánkiütés testszerte (urtikária);
- végtagzsibbadás (hipesztézia), rendellenes vagy csökkent érzékelés (paresztézia), ízérzészavar, szélütés (érelzárodás okozta agyérkatasztrófa = sztrók), aluszékonyság (szomnolencia);
- szívinfarktus (miokardiális infarktus), szívdobogásérzés (tahikardia);
- vérrögképződés (tromboembóliás események), vérnyomás-emelkedés (hipertenzió); kipirulás;
- a tüdőverőér elzáródása (tüdőembólia), a légutak szűkülete (bronhospazmus), nehézlégzés (diszpnoe), köhögés, légszomj;
- hányinger, hányás, hasmenés, kellemetlen érzés a hasban;
- az arc zsibbadása, az arc, nyelv és az ajkak duzzanata (angioödéma), viszketés;
- fájdalom az injekció helyén, általános rosszullét, melegségérzés, hidegérzet, láz, mellkasi fájdalom, mellkasi kellemetlen érzés.
A készítmény gyors intravénás befecskendezésekor vagy infúziós alkalmazásakor az arcban és a végtagokban szúró fájdalom és zsibbadás jelentkezhet, valamint vérnyomásesés következhet be.
Szívinfarktus azokban az esetekben fordult elő, amikor nagyobb adagot alkalmaztak a maximális napi adagnál és/vagy hosszan alkalmazták és/vagy tromboembóliás rizikófaktorok voltak jelen a betegnél.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát, gyógyszerészét, vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az alábbi elérhetőségek valamelyikén keresztül: Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézet, Postafiók 450, H-1372 Budapest, Magyarország, honlap: https://mellekhatas.ogyei.gov.hu/
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell a Feiba NF-et tárolni?
A gyógyszer gyermekektől elzárva tartandó!
Legfeljebb 25 °C-on tárolandó. Nem fagyasztható!
A fénytől való védelem érdekében az eredeti csomagolásban tárolandó.
A dobozon feltüntetett lejárati idő után (Felhasználható:) ne alkalmazza a Feiba NF-et. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Az elkészített oldat 20-25 °C-os hőmérsékleten 3 órán keresztül őrzi meg fizikai és kémiai stabilitását.
Mikrobiológiai megfontolások alapján, a Feiba NF oldatot elkészítése után azonnal fel kell használni. Kizárólag tiszta, részecskementes oldat használható fel.
Az elkészített oldat hűtőszekrényben nem tárolható.
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a Feiba NF?
Por:
- A készítmény hatóanyaga: Egy milliliter oldat 50 Egység VIII. koagulációs faktor-ellenanyagot megkerülő aktivitású faktorkomplexet tartalmaz.
A Feiba NF 50 Egység/ml kétféle kiszerelésben érhető el:
Feiba NF 500 Egységes kiszerelés: Egy injekciós üveg (10 ml) 500 Egység VIII. koagulációs faktor-ellenanyagot megkerülő aktivitású faktorkomplexet tartalmaz (200-600 mg plazmafehérjében.
Feiba NF 1000 Egységes kiszerelés: Egy injekciós üveg (20 ml) 1000 Egység VIII. koagulációs faktor-ellenanyagot megkerülő aktivitású faktorkomplexet tartalmaz (400-1200 mg plazmafehérjében).
A Feiba NF por (javarészt aktiválatlan) II., IX. és X. alvadási faktorokat, továbbá aktivált VII. faktort tartalmaz; a VIII. faktor-koaguláns antigén (F VIII C:Ag) szintje kisebb, mint 0,1 E/1 E Feiba NF. A kallikrein-kinin rendszer összetevői csupán nyomokban vagy egyáltalán nem fordulnak elő a készítményben.
- Egyéb összetevők: nátrium-klorid, trinátrium-citrát
Oldószer: steril injekcióhoz való víz
Milyen a készítmény külleme és mit tartalmaz a csomagolás?
A Feiba NF fehér, csaknem fehér vagy halványzöld liofilizált por vagy könnyen porladó anyag.
Az elkészített oldat pH-ja 6,8-7,6.
A por és az oldószer gumidugóval lezárt injekciós üvegekben kerül forgalomba.
Kiszerelés: 1×500 Egység
1×1000 Egység
Nem feltétlenül mindegyik kiszerelés kerül kereskedelmi forgalomba.
A doboz tartalma:
1 db Feiba NF 500 Egység/1000 Egység port tartalmazó, gumidugóval lezárt injekciós üveg
1 db 10 ml/20 ml steril injekcióhoz való vizet tartalmazó, gumidugóval lezárt injekciós üveg
1 db Baxject II Hi-Flow eszköz
1 db steril egyszer használatos fecskendő
1 db egyszer használatos tű
1 db steril szárnyas tű szorítóval (infúziós készlet)