Betegtájékoztató
1. Milyen típusú gyógyszer a Haemate P injekció és milyen betegségek esetén alkalmazható?
Mi a Haemate P injekció?
A Haemate P injekció egy porból és egy oldószerből áll. A kész oldatot injekcióként vagy infúzióként vénába kell beadni.
A Haemate P injekció készítményt emberi plazmából (a vér folyékony része) állítják elő és emberi von Willebrand faktort (VWF) és VIII. véralvadási faktort (FVIII) tartalmaz.
Mire használható a Haemate P injekció?
Mivel a Haemate P VIII. véralvadási faktort (FVIII) és von Willebrand faktort (VWF) is tartalmaz fontos tudni, hogy Önnek melyik faktorra van szüksége. Amennyiben Ön Haemofilia A betegségben szenved kezelőorvosa Haemate P-t fog Önnek felírni és megadja a FVIII egységek számát. Ha Önnek von Willebrand betegsége van, kezelőorvosa Haemate P-t fog Önnek felírni és megadja a VWF egységek számát.
Von Willebrand betegségben (VWD)
A Haemate P injekció a von Willebrand faktor hiánya miatt kialakuló vérzések megelőzésére és kezelésére használható olyan esetekben, amikor a dezmopresszin (DDAVP) egyedüli alkalmazása nem hatékony vagy ellenjavallt.
Hemofilia A betegségben (öröklött VIII. faktorhiány)
A Haemate P injekció a VIII. faktor hiánya okozta vérzések megelőzésére és kezelésére alkalmazható.
A készítmény alkalmazható szerzett VIII. faktorhiány kezelésére és VIII. faktor elleni ellenanyagokkal (antitestekkel) rendelkező betegek kezelésére is.
2. Tudnivalók a Haemate P injekció alkalmazása előtt
Az alábbi részek fontos információkat tartalmaznak az Ön kezelőorvosa számára, mielőtt a Haemate P injekciót alkalmazná Önnél.
Ne alkalmazza a Haemate P injekciót:
- ha Ön allergiás a humán eredetű von Willebrand faktorra, vagy a VIII. véralvadási faktorra vagy a gyógyszer (6. pontban felsorolt) bármely egyéb összetevőjére.
Tájékoztassa kezelőorvosát, ha allergiás bármilyen gyógyszerre vagy élelmiszerre.
Figyelmeztetések és óvintézkedések
Nyomonkövethetőség
Minden alkalommal, amikor Haemate P-t kap, kifejezetten javasolt, hogy rögzítse a beadás dátumát, az alkalmazott gyógyszer gyártási számát és beadott mennyiségét.
A Haemate P alkalmazása előtt beszéljen kezelőorvosával vagy gyógyszerészével
- allergiás vagy anafilaxiás reakciók (súlyos allergiás reakciónak tekinthető nehézlégzés vagy szédülés), esetén. Allergiás típusú túlérzékenységi reakciók előfordulhatnak. Kezelőorvosa tájékoztatja Önt a túlérzékenységi reakciók korai tüneteiről, köztük a csalánkiütésről, testszerte fellépő bőrkiütésről, mellkasi szorító érzésről, zihálásról, vérnyomásesésről és anafilaxiáról (súlyos allergiás reakciók melyek kifejezett nehézlégzést vagy szédülést okozhat). Amennyiben ezek a tünetek jelentkeznek, azonnal meg kell szüntetnie a készítmény beadását, és haladéktalanul kapcsolatba kell lépnie kezelőorvosával.
- Az inhibtorok, azaz gátló hatású ellenanyagok (antitestek) kialakulása egy ismert komplikáció, amely valamennyi VIII. véralvadási faktort tartalmazó készítmény alkalmazásakor előfordulhat. Ezek az inhibitorok - különösen akkor, ha nagy mennyiségben vannak jelen - megakadályozzák, hogy a kezelés megfelelően kifejtse a hatását, ezért gondosan ellenőrizni fogják, hogy Önnél/gyermekénél nem jelennek-e meg ilyen inhibitorok. Amennyiben a Haemate P alkalmazása mellett a vérzés nem kontrollálható Önnél, illetve gyermekénél a Haemate P-vel, azonnal tájékoztassa erről kezelőorvosát..
- ha szívbetegsége van, vagy a szívbetegség kockázata fennáll Önnél
- amennyiben Önnél egy centrális vénás kanülre van szükség a Haemate P beadásához, akkor kezelőorvosa mérlegelni fogja a kanül használatából eredő szövődmények - köztük a helyi fertőzések, baktériumok véráramba kerülése (bakterémia), valamint a kanül bevezetésének helyén az érben kialakuló vérrög (trombózis) - kockázatát.
Von Willebrand betegség:
- Ha Önnél nagy a valószínűsége, hogy véralvadék alakulhat ki (tromboembóliás szövődmény, beleértve véralvadék kialakulását a tüdőben) különösen abban az esetben, ha Önnél ismertek a klinikai vagy laboratóriumi kockázati tényezők (mint pl. vérrögképződést megelőző kezelés nélküli műtét és műtét utáni időszak, a korai mobilizálás elmaradása, elhízás, túladagolás, rosszindulatú daganat (karcinoma)). Ilyen esetben Önt folyamatosan ellenőrizni kell a trombózis tüneteinek megjelenésére. A vénás trombózis megelőzésére az ajánlásoknak megfelelően kell eljárni.
Kezelőorvosa a gyógyszer alkalmazása előtt gondosan mérlegeli a Haemate P-kezelés előnyeit, illetve a kezelés kockázatait.
Vírusbiztonság
Az emberi vérből vagy vérplazmából előállított gyógyszerkészítmények alkalmazásával okozott fertőzések megelőzésére szigorú szabályokat alkalmaznak. Ezek az alábbiak:
- a donorok kiválasztása szigorú szempontok szerint történik, a fertőzés hordozóinak kizárása érdekében
- az egyedi plazmaadományokat és a plazmakeverékeket ellenőrzik a vírusok és a fertőzések speciális jeleire.
- a vér és a plazma feldolgozásának folyamata olyan lépéseket tartalmaz, melyek hatástalanítják vagy eltávolítják a vírusokat.
Mindezek ellenére az emberi vérplazmából előállított gyógyászati készítmények alkalmazása során fertőző ágensek átvitele nem zárható ki teljesen. Ez vonatkozik az ez idáig ismeretlen vírusokra vagy más típusú kórokozókra is.
A rendszabályok megfelelően hatásosak a burokkal rendelkező vírusokkal szemben, mint pl. a humán immundeficiencia vírus (HIV, az AIDS vírusa) a hepatitisz B-, hepatitisz C-vírus (májgyulladás) és a burokkal nem rendelkező hepatitisz A-vírussal (májgyulladás) szemben.
Az alkalmazott eljárások hatékonysága korlátozott egyéb, burok nélküli vírusokkal, mint a parvovírus B19-cel szemben.
A parvovírus B19 fertőzés veszélyt jelenthet:
- terhes nőkre (magzati fertőzés létrehozásával) és
- azokra a betegekre, akik immunhiányosak vagy a vörösvértest-képződésük fokozott intenzitású (bizonyos vérszegénységek, mint sarlósejtes anémia, hemolitikus anémia).
Kezelőorvosa azt javasolhatja Önnek, hogy fontolja meg a hepatitisz A és B elleni védőoltások alkalmazását, amennyiben Ön rendszeresen kap emberi plazmából előállított von Willebrand faktor- és VIII. alvadási faktor-készítményeket.
Egyéb gyógyszerek és a Haemate P injekció
- Feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg vagy nemrégiben szedett, valamint szedni tervezett egyéb gyógyszereiről, beleértve a vény nélkül kapható készítményeket is.
- A Haemate P injekciót egyéb gyógyszerrel, oldószerrel és oldatokkal nem szabad keverni.
Terhesség, szoptatás és termékenység
- Ha Ön terhes vagy szoptat, kérje ki kezelőorvosa tanácsát, mielőtt bármilyen gyógyszert alkalmazna.
- A VIII. faktor terhesség és szoptatás ideje alatti alkalmazásával kapcsolatban nincsenek tapasztalatok, mivel az A típusú hemofília ritkán fordul elő nőknél.
- A von Willebrand betegség gyakrabban fordul elő nőknél, mint férfiaknál, mivel a menstruáció, terhesség, vajúdás, szülés és nőgyógyászati komplikációk fokozott vérzési kockázattal járnak. A forgalmazást követő tapasztalatok alapján a von Willebrand faktor pótlása az akut vérzés megelőzésében és kezelésében egyaránt ajánlatos. Klinikai vizsgálati adatok nem állnak rendelkezésre terhes vagy szoptató nők von Willebrand faktorral végzett pótló kezeléséről.
- Terhesség vagy szoptatás alatt a Haemate P injekciót csak akkor szabad használni, ha az egyértelműen indokolt.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
A Haemate P injekció nem befolyásolja a gépjárművezetéshez és a gépek kezeléséhez szükséges képességeket.
A Haemate P injekció nátriumot tartalmaz
A Haemate P 1200 NE VWF/500 NE FVIII 26 mg nátriumot tartalmaz injekciós üvegenként, ami felnőtteknél megfelel a WHO által ajánlott maximális napi 2 g nátriumbevitel 1,3%-ának.
A Haemate P 2400 NE VWF/1000 NE FVIII 52,5 mg nátriumot tartalmaz injekciós üvegenként, ami felnőtteknél megfelel a WHO által ajánlott maximális napi 2 g nátriumbevitel 2,6%-ának.
3. Hogyan kell alkalmazni a Haemate P injekciót?
A kezelést az ilyen típusú betegségek kezelésében jártas orvosnak kell bevezetnie és felügyelnie.
Adagolás
Az Ön kezeléséhez szükséges von Willebrand faktor és VIII. faktor mennyiségét és az alkalmazás időtartamát több tényező befolyásolja, pl. az Ön testsúlya, betegségének súlyossága, a vérzés helye és mértéke, vagy az a körülmény, hogy egy operáció vagy vizsgálat alatt felléphet-e vérzés, amit meg kell előzni. (lásd "Az alábbi információk kizárólag orvosoknak vagy más egészségügyi szakembereknek szólnak".)
Ha Önnek otthoni alkalmazásra írták elő a Haemate P injekciót, az Ön kezelőorvosa megbizonyosodik arról, hogy Ön tudja, hogyan kell beadni az injekciót és mennyi gyógyszert kell alkalmaznia.
Alkalmazáskor kövesse kezelőorvosa vagy a hemofília központ nővérének útmutatását.
Ha az előírtnál több Haemate P injekciót alkalmazott
A von Willebrand faktor (VWF) és a VIII. faktor (FVIII) túladagolásával kapcsolatos tüneteket nem jelentettek. Véralvadék (trombózis) kialakulásának kockázata azonban, nem zárható ki olyan VWF-készítmény extrém nagy dózisú alkalmazásánál, amely nagy mennyiségben VIII. faktort is tartalmaz.
Feloldás és alkalmazás
Általános teendők
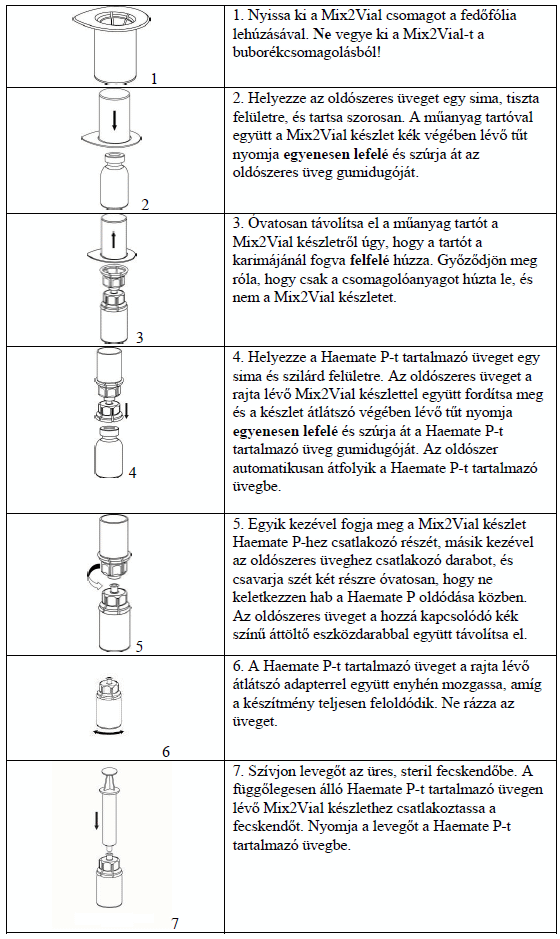
- A port az oldószerrel fel kell oldani, és az oldat felszívását aszeptikus körülmények között kell végezni.
- Feloldás után az oldat tiszta vagy kissé opálos. Feloldás után, alkalmazás előtt a felszívott, megszűrt (lásd alább) oldatot meg kell nézni és ellenőrizni kell, hogy nincsenek-e benne részecskék és színváltozás. A feloldásra vonatkozó utasítás szigorú betartása mellett is előfordulhat, hogy az oldatban pelyhes részecskék láthatók. A Mix2Vial áttöltő készletben lévő szűrő teljesen eltávolítja ezeket a részecskéket. A szűrés nem befolyásolja a szükséges dózis meghatározását.
- A szűrés után zavaros, részecskéket tartalmazó oldatot nem szabad felhasználni.
- Alkalmazás után a fel nem használt oldatot és a keletkezett hulladékot a helyi előírásoknak és az Ön kezelőorvosának utasításai szerint kell kezelni.
Feloldás
A Haemate P injekció port és oldószert tartalmazó injekciós üvegeit bontatlanul fel kell melegíteni szobahőmérsékletre. Ez megtehető úgy, hogy az üvegeket egy órán keresztül szobahőmérsékleten tartja, vagy néhány percig a kezében tartva melegíti. Direkt hő hatásának ne tegye ki az üvegeket. Az ampullákat nem szabad testhőmérsékletnél (37 °C) magasabb hőmérsékletre melegíteni.
Óvatosan távolítsa el a Haemate P-t és az oldószert tartalmazó injekciós üvegek védőkupakjait. Tisztítsa meg mindkét injekciós üveg gumidugóját 1-1 alkoholos törlőkendővel, majd hagyja megszáradni. Az oldószer áttölthető a port tartalmazó injekciós üvegbe a mellékelt Mix2Vial áttöltő készlettel. Az alábbi utasítások szerint járjon el:
Felszívás és alkalmazás
Alkalmazás
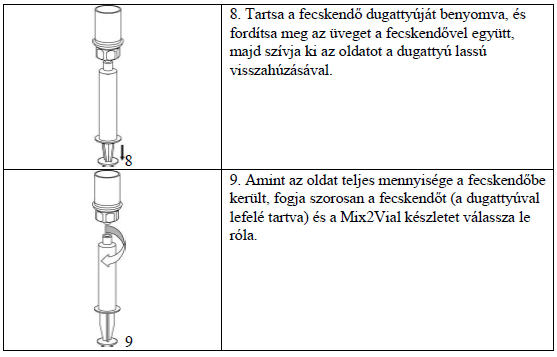
A Haemate P injekció beadására egyszer használatos műanyag fecskendőt kell használni, mivel az üveg fecskendő csiszolt felületére az ilyen típusú oldatok felragadhatnak.
Az oldatot lassan, vénába juttatva kell beadni, úgy, hogy az adagolás sebessége ne haladja meg a 4 ml/perc értéket. Ügyelni kell arra, hogy a gyógyszerrel teli fecskendőbe ne kerüljön vér. A fecskendőbe felszívott készítményt haladéktalanul be kell adni.
Amennyiben nagyobb mennyiségű faktor adagolására van szükség, infúzióként is beadható. A beadáshoz megfelelő infúziós szereléket kell használni. Az infúziót az Ön kezelőorvosának utasításai szerint kell alkalmazni.
Beadás alatt kísérje figyelemmel a reakcióit. Amennyiben olyan mellékhatást észlel, ami a Haemate P injekció alkalmazásával hozható kapcsolatba, az injekció/infúzió beadását azonnal be kell fejezni (lásd 2. pontot is).
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban kérdezze meg kezelőorvosát vagy gyógyszerészét.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így a Haemate P injekció is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
Az alábbi mellékhatásokat nagyon ritkán észlelték (10 000 beteg közül kevesebb, mint 1-et érint):
- hirtelen allergiás reakció (mint az arc, a szemhéjak, az ajkak, a nyelv és a torok duzzanata (angioödéma), égő és csípő érzés a beadás helyén, hidegrázás, kipirulás, csalánkiütés az egész testen, fejfájás, alacsony vérnyomás, levertség, hányinger, nyugtalanság, tahikardia, mellkasi szorító érzés, bizsergés, hányás, zihálás) nagyon ritkán fordult elő, és néhány esetben súlyos túlérzékenységi reakció (anafilaxia, beleértve a keringés-összeomlást (sokk)) is kialakult.
- testhőmérséklet emelkedése (láz).
Von Willebrand betegség
- Nagyon ritkán a trombotikus/tromboembóliás szövődmények, beleértve véralvadék kialakulását a tüdőben (vérrögök kialakulásának és vándorlásának kockázata az artériás/vénás rendszerben, ami hatással lehet a szervekre) kockázata fennáll.
- A von Willebrand faktor (VWF) készítmény alkalmazásakor a FVIII:C-szint nagymértékű emelkedése a véralvadék-képződés kockázatának növekedését okozhatja (lásd 2. pontot is).
- A von Willebrand-betegeknél nagyon ritkán kialakulhatnak a VWF-et semlegesítő ellenanyagok (inhibitorok). Inhibitorok megjelenése esetén a nem elégséges klinikai válasz folyamatos vérzést okozhat. Ez különösen azoknál a betegeknél fordulhat elő, akik a von Willebrand betegség speciális, ún. 3-as típusában szenvednek. Ezek kicsapódást okozó ellenanyagok és anafilaxiás reakciók esetén is előfordulhatnak. Ezért anafilaxiás reakció esetén, a semlegesítő ellenanyagok jelenlétének kimutatására vizsgálatot kell végezni. Minden ilyen esetben ajánlott kapcsolatba lépni a hemofilia-kezelő központtal.
Hemofilia A
- A VIII. véralvadási faktort tartalmazó gyógyszerekkel korábban még nem kezelt gyermekeknél nagyon gyakran (10 beteg közül több mint 1-nél) kialakulhatnak inhibitor-ellenanyagok (gátló hatású antitestek) (lásd a 2. pontot), viszont a VIII. faktorkészítménnyel korábban már (legalább 150 napig) kezelt betegeknél ez a kockázat nem gyakran (100 beteg közül kevesebb mint 1 beteget érinthet) jelentkezik. Ha bekövetkezik ez a komplikáció, előfordulhat, hogy a gyógyszer a továbbiakban nem fog hatni, és Ön, illetve gyermeke tartós vérzést tapasztalhat. Ilyen esetben azonnal forduljon kezelőorvosához.
Mellékhatások gyermekeknél és serdülőknél
Gyermekeknél a mellékhatások várhatóan azonosak a felnőtteknél előfordult mellékhatásokkal.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát vagy gyógyszerészét vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az alábbi elérhetőségek valamelyikén keresztül: Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézet, Postafiók 450, H-1372 Budapest, Magyarország, honlap: https://mellekhatas.ogyei.gov.hu/
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell a Haemate P injekciót tárolni?
A címkén és a dobozon feltüntetett lejárati idő (Felhasználható:) után ne alkalmazza a Haemate P injekciót.
- A gyógyszer gyermekektől elzárva tartandó!
- A címkén és a dobozon feltüntetett lejárati idő után ne alkalmazza a gyógyszert.
- Legfeljebb 25 °C-on tárolandó.
- Nem fagyasztható!
- A fénytől való védelem érdekében, a gyógyszer az eredeti csomagolásban tárolandó.
- A Haemate P injekció nem tartalmaz konzerválószert, ezért az elkészített oldatot azonnal fel kell használni.
- Ha a kész oldatot nem adták be azonnal, 3 órán belül fel kell használni.
- A fecskendőbe felszívott készítményt haladéktalanul be kell adni.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a Haemate P injekció
- Hatóanyagok: Humán von Willebrand faktor és humán VIII. alvadási faktor. Egy üveg 1200 vagy 2400 Nemzetközi Egység humán von Willebrand faktort és 500 vagy 1000 Nemzetközi Egység humán VIII. alvadási faktort tartalmaz.
- Egyéb összetevők: humán albumin, glicin, nátrium-klorid, trinátrium-citrát, nátrium-hidroxid vagy sósav (kis mennyiségben a pH beállítására)
Oldószer: injekcióhoz való víz
Milyen a Haemate P injekció külleme és mit tartalmaz a csomagolás
A Haemate P injekció egy steril fehér port tartalmazó ezüst/piros, illetve halványpiros/piros alumínium/műanyag kombikupakkal és brómbutil gumidugóval lezárt színtelen (II. típusú) injekciós üveget és egy tiszta, átlátszó injekcióhoz való vizet tartalmazó, szürke klórbutil vagy brómbutil gumidugóval és kék/kék műanyag lemezzel, rollnizott alumíniumkupakkal lezárt színtelen (I. típus) injekciós üveget tartalmaz. Feloldás után az oldat tiszta vagy kissé opálos, fény felé fordítva buborékok lehetnek benne, de látható, fel nem oldódott részecskék nem.
Kiszerelés:
Haemate P 1200 NE VWF/500 NE FVIII-t tartalmazó doboz:
1 db port tartalmazó injekciós üveg
1 db injekciós üveg 10 ml injekcióhoz való vízzel
1 db szűrővel ellátott áttöltő eszköz 20/20
Elkészítéshez és beadáshoz szükséges készlet (egy belső dobozban)
- 1 db 10 ml-es egyszer használatos fecskendő
- 1 db vénapunkcióra szolgáló készlet
- 2 db alkoholos törlő
- 1 db nem steril tapasz
Haemate P 2400 NE VWF/1000 NE FVIII-t tartalmazó doboz:
1 db port tartalmazó injekciós üveg
1 db injekciós üveg 15 ml injekcióhoz való vízzel
1 db szűrővel ellátott áttöltő eszköz 20/20
Elkészítéshez és beadáshoz szükséges készlet (egy belső dobozban)
- 1 db szűrővel ellátott áttöltő eszköz 20/20
- 1 db 20 ml-es egyszer használatos fecskendő
- 1 db vénapunkcióra szolgáló készlet
- 2 db alkoholos törlő
- 1 db nem steril tapasz
Nem feltétlenül mindegyik kiszerelés kerül kereskedelmi forgalomba.