Gyógyszerbiztonsági és terápiás döntéstámogató információk
TELEBRIX 30 Meglumine injekció 20x30 ml
Az alkalmazási előírás megtekintéséhez, kérjük, lépjen be PHARMINDEX Fiókjával!
Gyógyszerbiztonsági és terápiás döntéstámogató információk
Betegtájékoztató
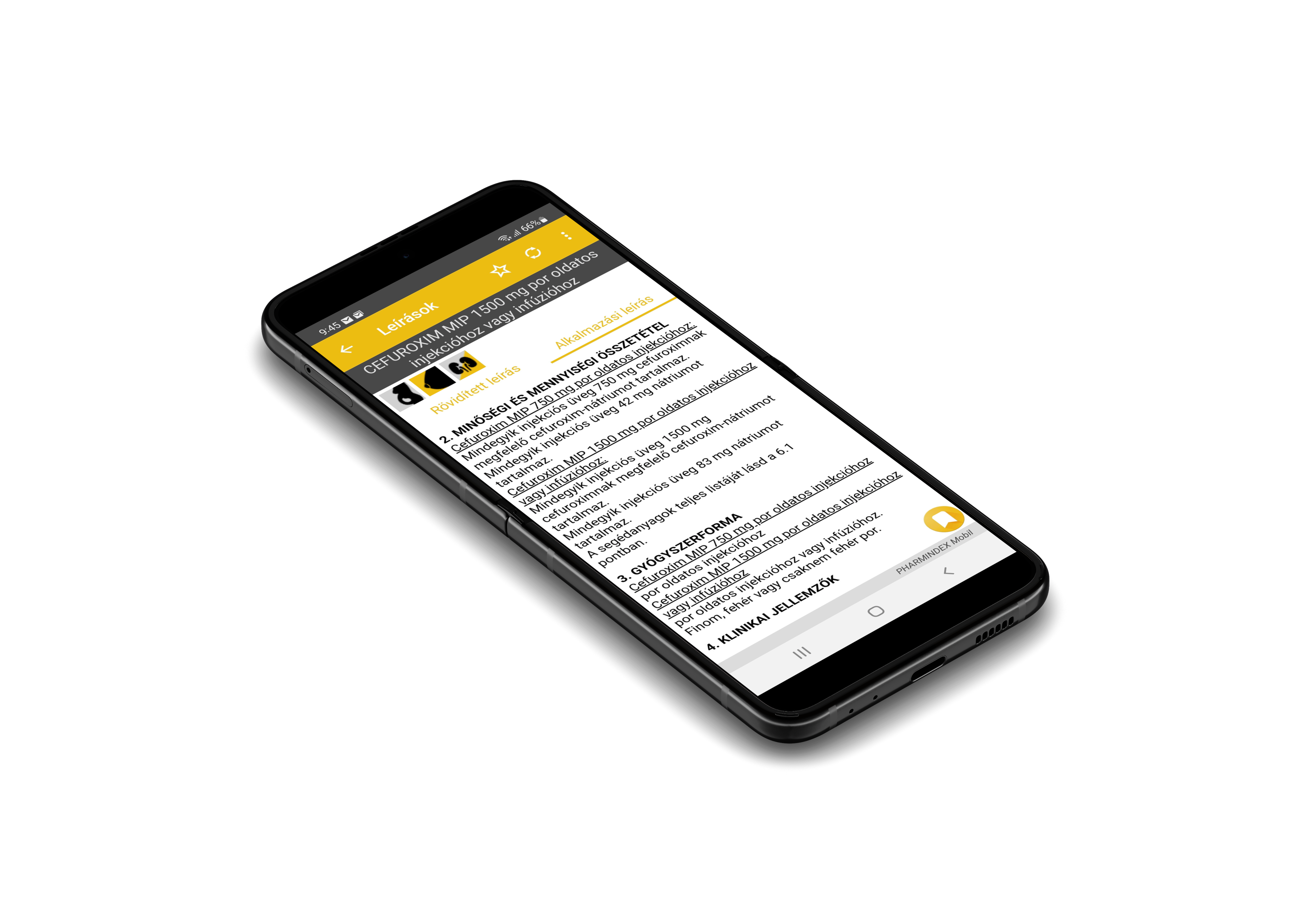
Hatóanyag:
30 ml: 19,81 g meglumini ioxitalamas (meglumin ioxitalamát) (acidum ioxitalamicum-ból és megluminum-ból) injekciós üvegenként.
50 ml: 33,015 g meglumini ioxitalamas (meglumin ioxitalamát) (acidum ioxitalamicum-ból és megluminum-ból) injekciós üvegenként.
Oldat injekció formájában 30, 50 ml üvegben.
1. MILYEN TÍPUSÚ GYÓGYSZER A TELEBRIX 30 MEGLUMINE INJEKCIÓ ÉS MILYEN BETEGSÉGEK ESETÉN ALKALMAZHATÓ?
Az injekció radiologiai vizsgálathoz (CT, vénák és a vizeletrendszer vizsgálatához) használt iodinált kontrasztanyag, intravénás alkalmazási móddal.
2. TUDNIVALÓK A TELEBRIX 30 MEGLUMINE INJEKCIÓ ALKALMAZÁSA ELŐTT
Nem alkalmazható az injekció:
- A készítmény összetevőivel szembeni túlérzékenység, pajzsmirigy-túlműködés, kiszáradásos (dehydrált) állapotok.
- Terhesség, szoptatás ideje alatt.
- Csecsemő és gyermekkor.
- A pókhálóhártya (arachnoidea) alá beadva.
Fontos információk
Tájékoztassa az injekciót beadó orvost amennyiben bármilyen allergiás problémája volt korábban, úgymint:
- jód tartalmú anyagokkal szembeni allergia, különösen korábbi radiologiai vizsgálat,
- különböző étel és gyógyszerallergia,
- csalánkiütés
- ekcéma,
- asztma,
- szénanátha.
Számoljon be minden betegségéről, melyről tudomása van, különösen: légzési, szív vagy veseelégtelenség, diabetes, myeloma multiplex, pajzsmirigy betegségek, hyperuricaemia (vérben mért magas húgysav szint), phaeochromocytoma (mellékvese daganat) mielőtt orvosa beadná az injekciót, hogy meg tudja tenni a kellő óvintézkedéseket.
Egyéb gyógyszerek alkalmazása (gyógyszerkölcsönhatás):
A különböző más készítményekkel való kölcsönhatások elkerülése érdekében, tájékoztatnia kell orvosát, gyógyszerészét minden más gyógykezeléséről.
Terhesség, szoptatás:
A kontrasztanyag alkalmazását követő jód-terhelés elméletileg magzati pajzsmirigy-zavarokat válthat ki, ha a vizsgálat az amenorrhoea után 14 héttel történik.
Ez mind a jód tartalmú kontrasztanyagra, mind az ionizáló radiációra vonatkoztatható.
Ezért terhesség ideje alatt csak a terápiás előny/kockázat gondos mérlegelésével alkalmazható.
A készítmény hatásai a gépjárművezetéshez és gépek üzemeltetéséhez szükséges képességekre
Nem ismert ilyen hatás.
3. HOGYAN KELL ALKALMAZNI A TELEBRIX 30 MEGLUMINE INJEKCIÓT?
Adagolás
Az adagolást a vizsgálat típusához és a vizsgált területhez kell megállapítani, valamint figyelembe kell venni a beteg testsúlyát és vese funkcióját.
A beadás módja és útja
Oldat intravénás injekcióhoz.
4. LEHETSÉGES MELLÉKHATÁSOK
Mint minden gyógyszernek a Telebrix 30 Meglumine injekciónak is lehetnek mellékhatási.
Enyhe mellékhatások:
- melegség érzet, mellkasi szorítás, köhögés
- hányinger, hányás
- levertség, izgatottság, fejfájás
- bőrelváltozások: urticaria, szemhély-vizenyő.
Nagyon ritkán:
- szívpanaszok: izzadással, a bőr és a mucosa kékes elszíneződésével.
Súlyosabb mellékhatások:
- szíveredetű ritmuszavarok, sápadtság, cianózis mely ritkán szívelégtelenséghez és kollapszushoz vezethet
- allergiás nehézlégzés, vérnyomásesés, hörgőgörcs, gégevizenyő, tüdővizenyő.
- idegrendszeri mellékhatások, tartós eszméletvesztés
TÁJÉKOZTASSA ORVOSÁT, GYÓGYSZERÉSZÉT MINDEN OLYAN MELLÉKHATÁSRÓL, AMI NINCS EMLÍTVE EBBEN A BETEGTÁJÉKOZTATÓBAN.
5. TÁROLÁS
Az injekciót szobahőmérsékleten (max. 25 °C), fénytől védve kell tárolni.
A gyógyszert csak a csomagoláson feltüntetett lejárati időn belül szabad felhasználni.
A gyógyszer gyermekektől elzárva tartandó!
A szöveg publikálásának dátuma az ema.europa.eu weboldalon: 2006. 10. 25.
A helyettesítő és hasonló termékek megtekintéséhez, kérjük, lépjen be PHARMINDEX Fiókjával!