EMA-2013: új gyógyszerek, új terápiás entitások
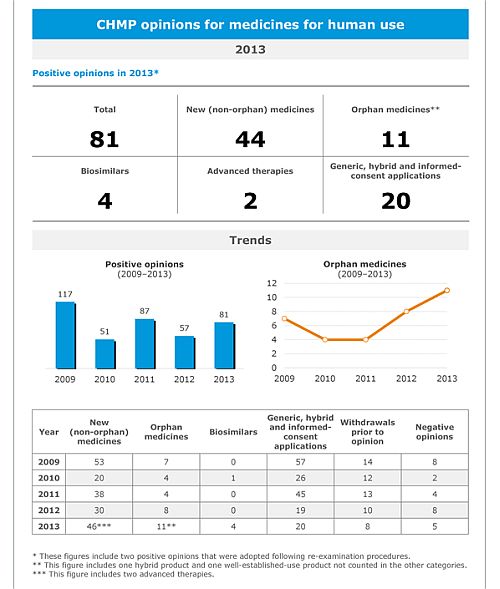
Az Európai Gyógyszerügynökség a tavalyi évben 81, míg 2012-ben 57 gyógyszer számára javasolta a forgalomba hozatal engedélyezését.
Az új gyógyszerek között az új hatóanyagok aránya (tehát olyan hatóanyag, amely korábban egyetlen gyógyszerkészítményben sem szerepelt) 38 volt, szemben a korábbi évekkel: 2010-ben 15, 2011-ben 25 és 2012-ben 35 új hatóanyag került a terápiába. A generikumok száma általában stabilnak mondható, de az elmúlt években bizonyos fokú csökkenés észlelhető.
A tavalyi engedélykérelmek esetén az EMA CHMP bizottságának tudományos szakvéleményét az esetek mintegy felében kérték ki előzetesen, a fejlesztés fázisában. Ez a tény jelentősen javította a forgalomba hozatali esélyeket, a tanácsot kérő kérelmezők mintegy 90%-ában sikerrel zárult a folyamat. A tudományos tanácsot nem kérők körében viszont csak kb. 30% volt a sikeresen zárult kérelmezések aránya.
Megjegyzendő, hogy 2013-ban két új fejlett (innovatív) terápiás entitás, ATMP is megkapta a forgalomba hozatali engedélyt. Ezzel négyre emelkedett azon készítmények száma, amióta (2009, majd 2012) az e készítményekkel kapcsolatos jogszabály életbe lépett. Ezek az innovatív gyógyszerek génterápiás / sejtterápiás / humán szövetekből származó készítmények, melyek alapjaiban új terápiás megoldásokat jelentenek egyes területeken.
A ritka betegségek kezelése terén is van előrelépés: 2013-ban 11 ilyen készítmény nyerte el a forgalomba hozatali engedélyt (2011-ben 4, 2012-ben pedig 8 forgalomba hozatal történt). Ez mutatja az EU árva gyógyszer-ritka betegség kérdéskörben hozott szabályozásának sikerét is (a törvény 2000-ben lépett hatályba).
2013 jelentős év volt a bioszimiláris, monoklonális antitestek szempontjából is, két ilyen engedélykérelem került elfogadásra, amely jelzi, hogy a bioszimiláris termékek koncepciója járható útnak látszik.
Daganatos betegségek, tbc-terápia
Igen jelentős tény, hogy a tavalyi évben a daganatos betegségek kezelésére 16 új gyógyszer forgalomba hozatala került engedélyezésre, ebből 12 új hatóanyag. A gyógyszerek nagy része célzott terápiás készítmény, amely a daganatok növekedését és terjedését oly módon gátolja, hogy hogy a tumornövekedésre ható specifikus molekulákat gátol, vagy a beteg immunrendszerere gyakorol hatást.
Szintén jelentős lépés a multidrug-rezisztens tuberkulózis kezelésére alkalmazott 3 új készítmény forgalomba hozatalának engedélyezése. Ez "árva" indikáció, ahol igen magas a halálozási arány, és az új készítmények korábbi hiánya miatt komoly a terápiás veszélyeztetettség népegészségügyi szempontból is.
Jelentősnek mondható még, hogy 2013-ban 4 új antiretroviralis készítmény került forgalomba, mind új terápiás entitások, valamint 5 új szer a 2-es típusú diabetes kezelésére, melyek közül 4 volt új vegyület.
Speciális módon szabályozott, támogatott forgalomba hozatal
Az EMA külön hangsúlyt fektet a feltételes, különleges körülményekre figyelmet fordító, és felgyorsított forgalomba hozatali eljárásokra. Itt olyan területekről beszélhetünk, ahol nincsen jelenleg elérhető gyógyszeres terápia, vagy azért nem lehet a normál szabályozás szerint benyújtani a kérelmet, mert a betegség igen ritka, és ennek kezelésével kapcsolatos klinikai evidenciák is szűk körűek.
Kilenc ilyen gyógyszer nyerte el tavaly a forgalomba hozatal kivételes, feltételes stb. engedélyét, 3 daganatellenes szer, egy himlő- (feketehimlő) ellenes oltás és 6 ritka betegség kezelésére alkalmazott szer.
A hepatitis C kezelésében tavaly két "jótékonysági" programot indítványozott a hatóság. Ennek lényege, hogy az életet veszélyeztető, vagy rendkívül súlyos fogyatékosságot okozó kórképben szenvedő betegek számára olyan terápiás lehetőséget biztosítanak, amelyek még fejlesztési fázisban vannak, és nem kerültek törzskönyvezésre/forgalomba.
Az EMA egyre nagyobb jelentőséget tulajdonít a betegek, betegegyesületek véleményének, észrevételeinek. Ez igen fontos a hatóság tudományos tevékenységének támogatásában. E vélemények, álláspontok kialakításában a betegszervezetek mellett figyelembe veszik az egészségügyben dolgozók véleményét, ad-hoc csoportok tevékenységét stb.
További információ
http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_and_events/news/2014/01/news_detail_002006.jsp&mid=WC0b01ac058004d5c1



