Gyógyszerfejlesztés ma: az FDA új definíciója a terápiás áttörés (breakthrough therapy) fogalma
Súlyos, vagy az életet veszélyeztető betegségek esetén, ahol nincsen kielégítő gyógyszerterápiás lehetőség, új kezelési metodikákat kell kidolgozni, és lehetőségek szerint felgyorsítani a gyógyszerré válás sebességét. Jelenleg egy gyógyszer klinikai fejlesztése átlagosan 7 évig tart, a klinikai hatás és humán gyógyszerbiztonságosság igazolása terén. Az FDA is jól bejáratott folyamatain keresztül juttatja el a gyógyszereket a törzskönyvezés és forgalomba hozatal elnyeréséig.
Az érintett betegek és jogi képviselőik azonban arra az álláspontra helyezkedtek, hogy sok esetben a hatósági procedúra hosszadalmasabb a szükségesnél. Az amerikai kongresszushoz beterjesztett kérelmek alapján 2012-ben jelent meg az FDA Safety and Innovation Act (FDASIA), amely már tartalmazza ezeket az igényeket. Két változtatást foganatosítottak a Federal Food, Drug, and Cosmetic Act törvényen, az egyik a "terápiás áttörés" definíció elfogadása volt a vizsgálat alatt álló gyógyszerjelöltek számára, a másik pedig a gyorsított forgalomba hozatali eljárás. A terápiás áttörésként való minősítés szinte egyértelműen a súlyos betegségek, állapotok kezelésére alkalmazott gyógyszereket jelenti.
Az új megnevezés a gyógyszerkutatás-fejlesztés új trendjeihez köthető. Ezek közül legfontosabb a célzott, molekuláris terápia, amely diagnosztikumokkal társult módon érvényesül, főként a daganatos és genetikai betegségek területén, valamint egyéb súlyos betegségekben. A terápiák eleve kiválasztott (kisebb) betegcsoportokon zajlanak, akiknél prediktív módon terápiás előny várható. A célzott gyógyszeres kezelés adott esetben lényegesen hatásosabb lehet, mint a jelenleg elérhető gyógyszerek, és a klinikai hatás már a korai humán vizsgálatokban nyilvánvaló.
Ha egy súlyos betegségben jelentős terápiás hatást tapasztalunk, már a korai humán vizsgálatok során, nyilvánvalónak tűnhet a tradicionális humán fázisok "átlépése" olyan megközelítések kidolgozása, amelyek felgyorsítják ezt a szakaszt, bár erre egyelőre még nincsen jól definiált metódusunk. A megoldások keresésének egyik módja pl. az amerikai Friends of Cancer Research and the Brookings Institution betegjogi képviseletek workshop-jai voltak, ahol fő témaként e gyógyszerek fejlesztésének lehetséges felgyorsítása szerepelt. Hosszas diszkussziókat követően a koncepciót törvénybe foglalták.
A fent említett FDASIA 902-es szekciójában említik, mi az a két fő kritérium, amely alapján az FDA egy gyógyszerjelöltet terápiás áttörésként minősíthet. Az első kitétel, hogy ilyen gyógyszer kizárólag súlyos, vagy az életet veszélyeztető betegség, állapot kezelésére kerülhet alkalmazásra. A második, hogy a gyógyszer az előzetes klinikai evidenciák alapján a meglévő terápiákhoz képest jelentős előrelépést kell mutasson egy vagy több klinikai szempontból releváns vizsgálati végpont vonatkozásában. Az FDA a második pontot úgy interpretálja, hogy teljesüléséhez nem elegendőek az állatkísérletes adatok, mindenképpen humán klinikai vizsgálat is szükséges.
Ha egy gyógyszer/jelölt megkapta a terápiás áttörés megjelölést, az FDA szoros együttműködést igényel a gyártó-fejlesztő céggel, annak biztosítására, hogy a lehető legjobb módszerrel elemezzék a klinikai hatás és a gyógyszerbiztonságosság kérdéskörét, a szükséges kiegészítő adatmennyiséget helyesen határozzák meg. Ez nyilvánvalóan a betegségtől, a rendelkezésre álló alapadatok mennyiségétől és a terápiás alternatíváktól függ. A rendelet kitér a kevésbé aktív kontroll-gyógyszer alkalmazására, amelyet lehetőség szerint korlátozni javasol.
Bár ez az etikai szabály minden gyógyszerfejlesztésre igaz, terápiás áttörés esetén különösen, ahol impresszionáló korai klinikai adatok állnak rendelkezésre. Ilyen esetekben mérlegelést igényelnek a betegek azonnali (terápiás) szükségletei – és a megbízható terápiás adatok nyerése közötti helyes egyensúly kialakítása. A terápiás áttörésként minősített gyógyszerek gyors fejlesztése egyéb nyomást is gyakorol a gyártókra: a végső gyógyszerformulálás kidolgozását, az ipari szintre történő sarzs-méretnöveléseket illetően, vagyis a gyógyszertechnológiai folyamatok egyidejű felgyorsítását. Egyes esetekben lehet, hogy éppen itt lesz a sebességmeghatározó lépés…
Természetesen arra nincsen garancia, hogy minden e minősítésben részesülő szerből valóban lesz gyógyszer, még akkor sem, ha a korai klinikai adatok erősen erre utalnak. A későbbi klinikai vizsgálatok felderíthetnek mérsékeltebb hatásosságot, nem tolerálható mellékhatásokat stb. Azt látni kell, hogy a terápiás áttörés mint minősítés nem azonos a forgalomba hozatali engedéllyel. Az FDA ellenőrző, hatósági szerepköre ebben a tekintetben nem fog változni, és ugyanolyan szigorúsággal fog eljárni, mint a tradicionális gyógyszerek esetén. Az FDASIA hatályba lépése óta egy év telt el, ezalatt 80 kérelem érkezett be, melyből 26 esetben kapta meg a gyógyszer/jelölt a terápiás áttörésként való minősítést, ezt mutatjuk be a táblázatban.
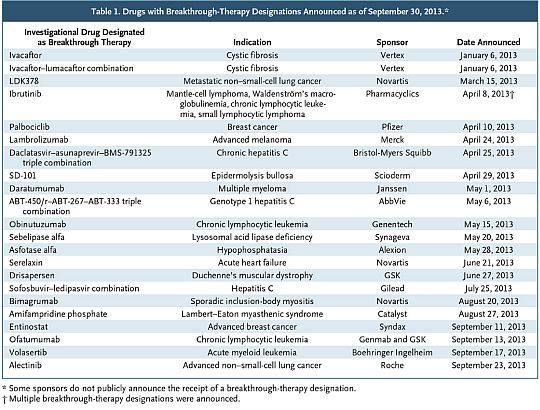
A terápiás áttörés mint gyógyszerminősítés érthető módon nagy érdeklődést váltott ki a betegek és jogi képviselőik körében. Ha most nem csak a program hatósági aspektusait, és a törzskönyvezési / forgalomba hozatali eljárást figyeljük, hanem úgy tekintünk rá, mint új terápiás paradigmára, könnyen láthatóvá válik, hogy a fő cél a betegségek biológiájának, patogenezisének jobb, pontosabb megértése. A tudomány, az alapkutatások fejlődésével a gyógyszerfejlesztésnek is lépést kell tartania.
http://www.nejm.org/doi/full/10.1056/NEJMp1311439?query=featured_home
Szponzorált tartalom



