Hogyan segíti az alapkutatás a gyógyszeripari marketinget?
A múlt század 70-es éveiben egy baltimore-i szenátort megvádoltak az érdekütközés vádjával. Volt egy kocsmája a városban, és hátráltatott egy rendeletet, ami rontotta volna üzleti érdekeit. A szenátor ezzel védekezett: "milyen érdekütközés? Hol ütközik mindez az én érdekeimmel…?" [1].
Az Institute of Medicine definíciója szerint az érdekütközés olyan helyzet, amikor a körülmények (nem hivatalos) másodlagos hatás, befolyás miatt kockáztatnak egy primer érdeket érintő professzionális döntést, vagy intézkedést [2]. Egyszerűbben fogalmazva érdekütközés az, amikor az egyén személyes érdeke ütközik hivatalos, professzionális, munkájából eredő érdekeivel. (vagy különböző, a munkából fakadó felelősségek, hatáskörök ütköznek). [3].
Az orvostudományi kutatásban hol csapódik le mindez? Az ipar (gyógyszeripar), az orvosok és a klinikai kutatás között alakulhat ki érdekütközés, versengő érdekek szituációja. Megjegyezzük, hogy az alapkutatásban dolgozó személyek sem érintetlenek ebben a tekintetben, és bizonyos esetekben igen fontos szerepet töltenek be, amikor a gyógyszeripar számára fontos marketing-üzeneteket hoznak létre, ill. terjesztenek.
Mennyire függ a kutatás az ipartól?
2007-ben, az USA-ban a gyógyszeripar volt az orvostudományi kutatás legnagyobb támogatója. Mintegy kétszeresét áldozta kutatási támogatásra (58%) mint a szövetségi kormány (33%). [4]. A támogatás legnagyobb része a klinikai kutatáshoz került, a preklinikai, és orvosi eszköz/műszeriparra fordított kutatási támogatás 1998-ban még 55%-ot jelentett, ez az arány 2010-re 25%-ra esett vissza. [5].
A 2007-es felmérés szerint 3,080 akadémiai kutató 53%-a részesült valamilyen formájú ipari támogatásban. [6]. Az 1,663 akadémiai orvosi kutatóegység közül az alapkutatók 42%-a állt kapcsolatban a gyógyszeriparral. Ez az arány hasonlónak mutatkozott népegészségügyi/klinikai epidemiológiai kutatóknál hasonló volt (40%), ennél magasabb arányú a klinikai kutatásban (67%) a transzlációs medicinában (61%), vagy a “multimodalis” kutatásban működő személyek esetén (71%) [7]. Amerikában 50 egyetem részesült abban az évben az NIH által adott kutatási támogatásban, az itt dolgozó 2167 kutató 43%-a jelezte, hogy munkája során valamilyen kutatással kapcsolatos "ajándékban" részesült a 90-es években. [8]. Az ajándékozás számos formája volt ismeretes, pl. biológiai anyagok, tetszés szerint felhasználható anyagi támogatás, eszközök, műszerek, kongresszusi részvétel támogatása, oktatási támogatás stb.
A kutatók általában tudták, hogy az ajándék fejében elvárt valamilyen viszonzás. A szponzorok szándéka volt, hogy az ajándékot megfelelő módon használják fel a megajándékozottak, viszont a tudományos publikációik köszönetnyilványításában tüntessék fel a szponzorok neveit. Zavaró körülményként jegyezte meg a kutatók 32%-a, hogy a szponzorok az igényelték, hogy az ajándékként kapott biológiai anyagokkal kapcsolatos publikációkat minél hamarabb tegyék közzé. A szponzor cégek mintegy 44%-a még azt is kikötötte, hogy ezen biológiai anyagok ne kerüljenek összevetésre a cégek (már forgalomban lévő) termékeivel. [8].
Gyógyszeripar - és a klinikai kutatási eredmények
A klinikai kutatásban résztvevő, és ipari támogatásban részesülő kutatók publikációiban felfedhető, hogy inkább támogatják a szponzorok marketing célkitűzéseit, mint azok, akik nem részesültek az ipar által nyújtott szponzorációban. A Cochrane Collaboration 48 olyan klinikai vizsgálatot, szisztémás review-t és meta-analízist elemzett, ahol gyógyszerek/orvosi műszerek vizsgálataival kapcsolatos eredményeket publikáltak – ipari támogatottság mellett. A Cochrane elemzés szerint az ipar által szponzorált vizsgálatok (szemben a nem ipari forrásból támogatottakkal), inkább az előnyök, hatásosság kiemelésére koncentráltak, kevésbe a káros hatásokra, hátrányokra, kockázatokra, és általában arra a konklúzióra jutottak, hogy a terápia előnyös, hatékony. [9].
Eredmények, hibák, torzítások a kutatásban
Az állatokon végezett (preklinikai) kutatás eredményei gyakran nem igazolódnak a klinikai vizsgálatokban. Nem mindegy milyen állatfajon történik a vizsgálat, de fontos a vizsgálati terv, az eredményekkel, biostatisztikával és a publikációval kapcsolatos hibák, torzulások kezelése is.
Egy újabb kutatás szerint, 4445 preklinikai vizsgálatban, neurológiai gyógyszerjelöltek esetén végzett 160 meta-analízisben túl magas volt a pozitív eredménnyel zárult vizsgálatok aránya (1,719 study) míg az előzetes elvárások csak ennek felét prognosztizálták (919 study). [10]. Itt is a vizsgálati terv és a publikációs hibák szolgálhatnak magyarázatul. A meta-analízisekben a vizsgálatok több mint 2/3-a, 70% jelezte, hogy szignifikáns adott szer hatékonysága, ezek közül 108/112 esetben az aktív vizsgálati szert részesítették előnyben, míg a kontrollként alkalmazott szer javára csak 4 vizsgálat döntött… A csak 500 feletti állatszámon végzett vizsgálatok tekintetében észlelt pozitív terápiás hatás esetén jellemző adat, hogy az alkalmazott 160 szer közül összesen 8 (5%) jutott tovább klinikai kutatási fázisba. [10].
A sejtkultúrákkal végzett tanulmányok eredményeit is torzíthatja hibás interpretáció. Pl. az erythropoetin-stimuláló szerek (ESAs), a 90-es évek elején kerültek forgalomba, daganatos betegek anaemiájának kezelésére, széles körben kerültek alkalmazásra. A korai klinikai publikációk és meta-analízisek szerint az ESA-k a mortalitást is előnyösen befolyásolták. [11]. Ma már tudjuk, hogy daganatos betegeken növelhetik a thromboemboliák, a cardiovascularis események számát és az összesített mortalitást [12]; zavaró volt, hogy ezek a kockázatok pontosan a publikációk és jelentések hibái és torzításai miatt nem kerültek hamarabb felszínre [11].
Jóval a mortalitási kockázat megállapítása előtt kérdések merültek fel az ESA-k potenciális mellékhatásait illetően. Az alapkutatások vizsgálták, hogy e szerek elősegítik-e a malignitások kialakulását. A publikációk elemzése során kiderült, hogy az ESA-gyártók által támogatott kutatók kevésbé említették a tumornövekedéssel kapcsolatos hatás észlelését, mint azok, akik nem kaptak támogatást e cégektől. [13].
A gyártói támogatás nélkül kutatók 57%-a jutott arra a konklúzióra, hogy az ESA-k malignitást keltő hatásúak lehetnek, míg a gyártók által támogatottak közül egyetlen kutató sem említett ezt. Az ipar támogatta kutatás még azt is jelezte, hogy az erythropoietin tumorellenes hatással bír (!) [13]. Egyszerűbben: az ipar által támogatott kutatók részrehajlóak voltak az eredmények bemutatásakor. Bár nem eldöntött kérdés, hogy az ESA-k elősegítik-e a humán tumor-progressziót, a fent vázoltak mégis figyelmeztető erővel bírnak.
Szelektív publikálás és prezentáció
Ez meglehetősen ismert gyógyszeripari taktika. Az ipar él a tudományos ülések, kongresszusok által biztosított lehetőséggel, és abstractok, poszterek révén küld marketing-üzeneteket a szakmai közönség számára. A helyzet egyszerűbb, mint a szaklapi publikációk esetén, a kongresszusi anyagokat ugyanis nem kell a peer-review-nak, tehát a gondos szakmai lektorálásnak alávetni, a bemutatás időpontjáig lehet módosítani. Sok esetben preklinikai eredményeket, előzetes klinikai eredményeket, klinikai esettanulmányokat prezentálnak a kongresszusokon. Az ígéretes előzetes eredmények megjelennek a poszteren, aztán ha a végső konklúziók mégsem előnyösek kereskedelmi szempontból, a teljes publikáció vagy nem kerül nyilvánosságra, vagy "eltemetik" egy alacsony impakt faktorú szaklapban. A kutató úgy érezheti a kongresszusi poszter, előadás alapján hogy ez egy hatékony szer – később már nem keresi a végső publikációt a szaklapokban…
A kongresszusi abstractok, poszterek nagy része sehol sem kerül publikálásra, de ha igen, szinte csak azok, amelyek pozitív hatásról számolnak be. [14],[15]. 2007-es Cochrane review szerint, 79 jelentés számolt be arról, hogy tudományos rendezvényeken elhangzott/bemutatott 29.729 abstract-nak csak 44%-a került később publikálásra, mint lezárt, teljes tanulmány. [14]. Újabb vizsgálatok szerint pl. nefrológián belül az éves kongresszusokon prezentált anyagok 42%-a még 4,5 évvel később sem került publikálásra, [16]; vagy idegsebészeti kongresszust követően 32% volt a hasonló arány [17]; gyógyszeraddikcióval kapcsolatos meeting-et követően az összefoglalók 62%-a került később publikálásra [15].
A klinikai vizsgálatok szelektív publikálását illetően, egy anonimitását fenntartó, korábban gyógyszeripari vezető így nyilatkozott:
“Az ipar számára előnyös helyzet, hogy szelektív módon választhatja meg, mely kutatókat támogat: azokat, akik marketing céljaiknak megfelelő publikációkat írnak, állítanak össze."
A kutatókat persze nem lehet arra kényszeríteni, hogy mindenáron publikálják eredményeiket. Ez komoly, időigényes és alapos munka, nyilván kevéssé motiváltak arra, hogy negatív eredményeket publikáljanak – ezek kisebb impakttal bírnak, mint a pozitív eredménnyel zárult vizsgálatok. Anekdotisztikus értékű, hogy a "nívós" szaklapok nem publikálnak negatív eredményeket, de az is igaz, hogy amit nem nyújt be a kutató, a cikkíró – azt nem lehet publikálni. Egy gasztroenterológiai kongresszus mérlege: 156/206 tanulmány 76%-a sohasem jelent meg – de be sem nyújtották azokat a szerzők. [18].
Természetesen vannak negatív eredményeket publikáló szaklapok is, ezt mutatjuk be a táblázatban.
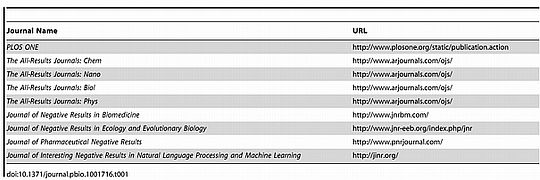
Alapkutatások – és a gyógyszermarketing
A preklinikai vizsgálatok szerepe (már piacra került gyógyszerek esetén) a mellékhatásokkal kapcsolatos aggályok eloszlatása mellett főként az, hogy olyan hatásra vessenek fényt, amely humán körülmények között nem érvényesült, vagy nem nyert igazolást. Erről is nyilatkozott a fent említett korábbi gyógyszeripari szakember:
“Az alapkutatásokból származó eredmények alkalmasak lehetnek arra, hogy indirekt – esetenként direkt marketing üzeneteket fogalmazzanak meg, egy hatásmechanizmussal, vagy a hatást és biztonságosságot illető másodlagos markerekkel kapcsolatosan. Cél, hogy egy adott szer elkülöníthető legyen a kompetitoroktól. A preklinikai kutatás akadémiai rendezvényeken alkalmas lehet klinikailag releváns üzenetek hordozására, már ami a tudományos megalapozottságot jelenti."
Egy gyógyszer beharangozása már 7-10 évvel a törzskönyvezés és forgalomba hozatal előtt megkezdődhet [21], még a preklinikai stádiumban, ahol egy érdekesnek tűnő eredmény pezsgést generálhat… Egy példa: a rimonabant (endocannabinoid antagonista) preklinikai és klinikai vizsgálataiban bizonyos hibák keletkeztek, még a törzskönyvezést megelőzően [22]. Európában a rimonabant 2006-ban került forgalomba az obesitas kezelésére, majd 2008-ban kivonták, miután szuicid eseményeket jelentettek, és egyéb pszichiátriai mellékhatásokat. Az FDA eleve nem törzskönyvezte a rimonanabant-ot.
Ha egy gyógyszer forgalomba, piacra kerül, már off-label, azaz nem deklarált, hatóság által elfogadott indikációban is alkalmazható. Az orvos megteheti, hogy egy gyógyszert off-label alkalmazásra rendel a betegnek, de a gyártó/forgalmazó nem teheti meg. Hogy off-label alkalmazást promotál. Nem ritka az off-label alkalmazás, becslések szerint a gyógyszerrendelések 1/5-e ilyen célra történik. [23].
Erre is egy élő példa, az egyik gabapentin-gyártó stratégiája. A cég kutatók, konzulensek, szakértők alkalmazásával éri el távolabbi célját. [24]. A konkrét esetben ez a szer annak idején csak epilepszia indikációval jelent meg, de számos orvos bevonásával tágítani kívánták a kört, és off-label indikációként neurológusok között, rendezvényeken, arról számoltak be, hogy milyen előnyös a gabapentin alkalmatása neuropathiás fájdalom és depresszió esetén is. (Ezek akkor off-label indikációk voltak értelemszerűen, a depresszió ma is az.) Az off-label alkalmazással kapcsolatosan továbbképző programokat hoztak létre, és egyre szélesebb körben terjesztették az információt a tudományos szakirodalomban… [25].
Kik azok a "tudományos négerek, szellemírók"?
A cégek dollármilliókat(!) fizettek az off-label promóciók büntetéseként, ebben tételként nemcsak a cégek által fizetett kutatás, szakértők, előadók szerepeltek, hanem pl. a tudományos négereknek nevezett (ghostwriters) szakírók tevékenysége is, akik olyan "előnyös hatást leíró" cikkeket generáltak, amelyek mögött nem állt konkrét klinikai vizsgálat, vagy csak negatív eredményekkel záruló.
A büntetés indoklásában említésre került, hogy a klinikusokat nem értesítették a kockázatokról, vagy azokat bagatellizálták. [34]. 2012-ben az egyik nagy cég rosiglitazon-készítményével fordult elő, hogy a mellékhatások nem kerültek bejelentésre, és két antidepresszáns készítményüket off-label is promotálták. Ezért az amerikai kormány rekordméretű büntetést szabott ki… [35]. Az egyik antidepresszáns esetén a tudományos néger szakírók felemlítették a szer hatékonyságát adoleszcens depresszió esetén, pedig a cikkben citált vizsgálat sem a primer sem a szekunder végpontokban nem bizonyított hatékonyságot, a mellékhatásokat pedig jelentéktelennek tüntették fel.
Összegzés
Az orvostudományi kutatás függ a gyógyszeripartól. A szponzori ajándékok elfogadása, vagy a szerkesztésben, biostatisztikában nyújtott "segítség" lehetőséget ad a cégek számára egy gyógyszer promotálára – és a kompetitorok hátrányainak exponálásra. Mindez, főként a szellemírás, a kongresszusi publikációk, a negatív riportok nem publikálása, vagy "eltemetése" nem minősíthető etikus magatartásnak.
A negatívan záruló tanulmányok alulreprezentáltsága nemcsak ezért problematikus, hanem károsítja az orvostudományi szakirodalmat, egyes terápiák a valóságosnál jobbnak feltüntetése révén félrevezetheti a kutatókat és gyakorló klinikusokat egyaránt. Nem szólva mindezek népegészségügyi hatásairól. A tudományos közösségnek éppoly kötelessége a negatív eredmények közzététele is, mint az eredményesen zárult vizsgálatoké, pontosan a kockázatok helyes felmérése céljából a napi gyakorlat számára.
A volt gyógyszeripari szakember erről így gondolkodik:
“Mivel az ipar alapvető támogató fél a kutatások szponzorálásában, jelentős és mondhatni napi kapcsolatok alakultak ki akadémiai és ipari partnerséggel, részvétellel. Pont ez a partnerkapcsolat kell ösztönözze a kutatókat arra, hogy értékes munkákat tegyenek le az asztalra, olyan értékeket, amelyek túlmutatnak a gyógyszerfejlesztési érdekeken."
További információ, részletek az eredeti cikkben:
http://www.plosbiology.org/article/info:doi/10.1371/journal.pbio.1001716;jsessionid=9EAACEDB7ACCF9A902A8627D19D7917A
Irodalom
1. Rascovar B (31 March 1999) Lawmakers undermine court reform. Baltimore Sun Available: http://articles.baltimoresun.com/1999-03-31/news/9903310338_1_bail-bondsmen-licensed-bail-bondsman-bail-bond-business. Accessed 28 October 2013.
2. IOM (Institute of Medicine) (2009) Conflict of interest in medical research, education, and practice. Washington, DC: The National Academies Press. Available: http://www.ncbi.nlm.nih.gov/books/NBK22942/pdf/TOC.pdf. Accessed 28 October 2013
3. Cain DM, Loewenstein G, Moore DA (2005) The dirt on coming clean: perverse effects of disclosing conflicts of interest. Journal of Legal Studies 34: 1–25. doi: 10.1086/426699.
4. Dorsey ER, de Roulet J, Thompson JP, Reminick JI, Thai A, et al. (2012) Funding of US biomedical research, 2003–2008. JAMA 303: 137–43.
5. Moses H, Dorsey ER (2012) Biomedical research in an age of austerity. JAMA 308: 2341–2342. doi: 10.1001/jama.2012.14846.
6. Zinner DE, Bolcic-Jankovic D, Clarridge B, Blumenthal D, Campbell EG (2009) Participation of academic scientists in relationships with industry. Health Aff (Millwood) 28: 1814–25. doi: 10.1377/hlthaff.28.6.1814.
7. Zinner DE, Campbell EG (2009) Life-science research within US academic medical centers. JAMA 302: 969–76. doi: 10.1001/jama.2009.1265.
8. Campbell EG, Louis KS, Blumenthal D (1998) Looking a gift horse in the mouth: Corporate gifts supporting life sciences research. JAMA 279: 995–999. doi: 10.1001/jama.279.13.995.
9. Lundh A, Sismondo S, Lexchin J, Busuioc OA, Bero L (2012) Industry sponsorship and research outcome. Outcome reporting among drug trials registered in ClinicalTrials.gov. Cochrane Database Syst Rev 12: MR000033. doi: 10.1002/14651858.mr000033.pub2.
10. Tsilidis KK, Panagiotou OA, Sena ES, Aretouli E, Evangelou E, et al. (2013) Evaluation of excess significance bias in animal studies of neurological diseases. PLOS Biol 11: e1001609 doi: 10.1371/journal.pbio.1001609.
11. Tonia T, Schwarzer G, Bohlius J (2013) Cancer, meta-analysis and reporting biases: The case of erythropoiesis-stimulating agents. Swiss Med Wkly 7: w13776.
12. Tonia T, Mettler A, Robert N, Schwarzer G, Seidenfeld J, Weingart O, Hyde C, Engert A, Bohlius J (2012) Erythropoietin or darbepoetin for patients with cancer. Cochrane Database Syst Rev 12: CD003407. doi: 10.1002/14651858.cd003407.pub5.
13. Bennett CL, Lai SY, Henke M, Barnato SE, Armitage JO, Sartor O (2010) Association between pharmaceutical support and basic science research on erythropoiesis-stimulating agents. Arch Intern Med 170: 1490–8. doi: 10.1001/archinternmed.2010.309.
14. Scherer RW, Langenberg P, von Elm E (2007) Full publication of results initially presented in abstracts. Cochrane Database Syst Rev 18: MR000005. doi: 10.1002/14651858.mr000005.pub2.
15. Vecchi S, Belleudi V, Amato L, Davoli M, Perucci CA (2009) Does direction of results of abstracts submitted to scientific conferences on drug addiction predict full publication? BMC Med Res Methodol 9: 23 doi: 10.1186/1471-2288-9-23.
16. Harel Z, Wald R, Juda A, Bell CM (2011) Frequency and factors influencing publication of abstracts presented at three major nephrology meetings. Int Arch Med 4: 40 doi: 10.1186/1755-7682-4-40.
17. Patel AJ, Cherian J, Fox BD, Whitehead WE, Curry DJ, et al. (2011) Publication patterns of oral and poster presentations at the annual meetings of the Congress of Neurological Surgeons and the American Association of Neurological Surgeons. J Neurosurg 115: 1258–61. doi: 10.3171/2011.7.jns101538.
18. Timmer A, Hilsden RJ, Cole J, Hailey D, Sutherland LR (2002) Publication bias in gastroenterological research - a retrospective cohort study based on abstracts submitted to a scientific meeting. BMC Med Res Methodol 2: 7.
19. Bourgeois FT, Murthy S, Mandl KD (2010) Outcome reporting among drug trials registered in ClinicalTrials.gov. Ann Intern Med 153: 158–66. doi: 10.7326/0003-4819-153-3-201008030-00006.
20. Sena ES, van der Worp HB, Bath PMW, Howells DW, Macleod MR (2010) Publication bias in reports of animal stroke studies leads to major overstatement of efficacy. PLOS Biol 8: e1000344 doi: 10.1371/journal.pbio.1000344.
21. Coyle L, Benner D (2005) To market, to market: The seven steps of launch effectiveness. Product Management Today Jan 24–27.
22. McPartland JM (2009) Obesity, the endocannabinoid system, and bias arising from pharmaceutical sponsorship. PLOS ONE 4: e5092 doi: 10.1371/journal.pone.0005092.
23. Radley DC, Finkelstein SN, Stafford RS (2006) Off-label prescribing among office-based physicians. Arch Intern Med 166: 1021–1026. doi: 10.1001/archinte.166.9.1021.
24. Fugh-Berman A, Melnick D (2008) Off-label promotion, on-target sales. PLOS Med 5: e210 doi: 10.1371/journal.pmed.0050210.
25. Steinman MA, Bero LA, Chren MM, Landefeld CS (2006) Narrative review: the promotion of gabapentin: an analysis of internal industry documents. Ann Intern Med 145: 284–93. doi: 10.7326/0003-4819-145-4-200608150-00008.
26. Coker LH, Espeland MA, Rapp SR, Legault C, Resnick SM, et al. (2010) Postmenopausal hormone therapy and cognitive outcomes: the Women's Health Initiative Memory Study (WHIMS). J Steroid Biochem Mol Biol 118: 304–10. doi: 10.1016/j.jsbmb.2009.11.007.
27. Rosenberg M (2010) Hormone therapy makes comeback in New York Times magazine. Are cigarettes next? Op-Ed News Available: http://www.opednews.com/articles/Hormone-Therapy-Makes-Come-by-Martha-Rosenberg-100420-14.html. Accessed 28 October 2013.
28. Rosenberg M (25 January 2010) Hormones still pushed, still dangerous. Huffington Post Available: http://www.huffingtonpost.com/martha-rosenberg/hormones-still-pushed-sti_b_801540.html. Accessed 28 October 2013.
29. Writing Group for the Women's Health Initiative Investigators (2002) Risks and benefits of estrogen plus progestin in healthy postmenopausal women: Principal results from the Women's Health Initiative randomized controlled trial. JAMA 288: 321–33. doi: 10.1001/jama.288.3.321.
30. Fugh-Berman AJ (2010) The haunting of medical journals: How ghostwriting sold “HRT”. PLOS Med 7: e1000335 doi: 10.1371/journal.pmed.1000335.
31. Drug Industry Document Archive (DIDA) (January 18, 2005) The atherosclerotic process and the impact of estrogens - outline. Available: http://dida.library.ucsf.edu/pdf/plb37b10. Accessed: 28 October 2013
32. DIDA [undated] The atherosclerotic process and the impact of estrogens – need a new title. Available: http://dida.library.ucsf.edu/tid/pgc37b10 Accessed: 28 October 2013
33. DIDA [undated] The impact of timing of initiation of therapy on the cardiovascular effects of postmenopausal hormone replacement therapy. Available: http://dida.library.ucsf.edu/pdf/gwc37b10. Accessed: 28 October 2013
34. Groeger L (3 July 2012) Big pharma's big fines. ProPublica Available: http://projects.propublica.org/graphics/bigpharma. Accessed: 28 October 2013.
35. U.S Department of Justice. US complaint. United States District Court for the District of Massachusetts. C.A. no 11-10398-RWZ. United States ex rel. Greg Thorpe, et al v. GlaxoSmithKline PLC and GlaxoSmithKline LLC. Available: http://www.justice.gov/opa/gsk-docs.html. Accessed: 28 October 2013
36. Moffatt B, Elliott C (2007) Ghost marketing: pharmaceutical companies and ghostwritten journal articles. Perspect Biol Med Winter 2007 50 (1) 18–31. doi: 10.1353/pbm.2007.0009.
37. Sismondo S (2007) Ghost management: how much of the medical literature is shaped behind the scenes by the pharmaceutical industry? PLOS Med 4: e286 doi: 10.1371/journal.pmed.0040286.
38. Braun SR (2013) Promoting “Low T”: a medical writer's perspective. JAMA Intern Med 173: 1458–60 doi: 10.1001/jamainternmed.2013.6892.
39. Spielmans GI, Parry PI (2010) From evidence-based medicine to marketing-based medicine: Evidence from internal industry documents. Bioethical Inquiry 7: 13–29. doi: 10.1007/s11673-010-9208-8.
40. Lacasse JR, Leo J (2010) Ghostwriting at elite academic medical centers in the United States. PLOS Med 7: e1000230 doi: 10.1371/journal.pmed.1000230.
41. Stern S, Lemmens T (2011) Legal remedies for medical ghostwriting: Imposing fraud liability on guest authors of ghostwritten articles. PLOS Med 8: e1001070 doi: 10.1371/journal.pmed.1001070.



