Betegtájékoztató
1. Milyen típusú gyógyszer az ADYNOVI és milyen betegségek esetén alkalmazható?
Az ADYNOVI hatóanyaga az alfa-rurioktokog pegol, pegilált humán VIII-as véralvadási faktor. A humán VIII-as véralvadási faktort módosítják hatástartama meghosszabbítása érdekében. A VIII-as faktor szükséges a véralvadáshoz, vagyis a vérzések elállításához. Az "A" típusú hemofíliás (a VIII-as faktor veleszületett hiányában szenvedő) betegeknél ez hiányzik, vagy nem működik megfelelően.
Az ADYNOVI a vérzés kezelésére és megelőzésére szolgál 12. életévüket betöltött, "A" típusú hemofíliával (a VIII-as faktor hiánya által okozott öröklött vérzési rendellenességgel) diagnosztizált betegeknél.
2. Tudnivalók az ADYNOVI alkalmazása előtt
Ne alkalmazza az ADYNOVI-t
- ha allergiás az alfa-rurioktokog pegolra, az alfa-oktokogra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére
- ha allergiás az egér- vagy hörcsögfehérjére Ha ebben bizonytalan, forduljon kezelőorvosához.
Figyelmeztetések és óvintézkedések
Fontos nyilvántartást vezetni az ADYNOVI gyártási számáról. Ennek érdekében, minden alkalommal, amikor egy új ADYNOVI dobozt kap, jegyezze fel a készítmény dobozán található dátumot és gyártási számot (Lot) és tárolja biztonságos helyen ezt az információt.
Az ADYNOVI alkalmazása előtt beszéljen kezelőorvosával.
Ritkán az ADYNOVI hatására anafilaxiás reakciót (súlyos, hirtelen kialakuló allergiás reakciót) tapasztalhat. Tisztában kell lennie az allergiás reakciók korai tüneteivel, mint például kiütés, csalánkiütés, testszerte jelentkező viszketés, ajak- és nyelvduzzanat, sípoló légzés, mellkasi szorító érzés, rossz közérzet és szédülés. Ezek az anafilaxiás sokk korai tünetei lehetnek, amely ezen felül erős szédüléssel, eszméletvesztéssel és súlyos nehézlégzéssel járhat együtt.
Ha a fenti tünetek bármelyikét tapasztalja, azonnal állítsa le az injekció adását, és forduljon kezelőorvosához. A súlyos tünetek - többek közt a légzési nehézség és az ájulás (vagy ájulás közeli állapot) - azonnali sürgősségi ellátást igényelnek.
Ha szívbetegségben szenved, kérjük, tájékoztassa kezelőorvosát, mivel nagyobb a véralvadási szövődmények kockázata.
VIII-as faktort gátló ellenanyagokat termelő betegek
Az inhibitorok, azaz gátló hatású ellenanyagok (antitestek) kialakulása egy ismert szövődmény, amely valamennyi VIII-as faktor tartalmú készítmény alkalmazásakor előfordulhat. Ezek az inhibitorok - különösen akkor, ha nagy mennyiségben vannak jelen - megakadályozzák hogy a kezelés megfelelően kifejtse a hatását, ezért gondosan ellenőrizni fogják, hogy Önnél, illetve gyermekénél nem jelennek-e meg ilyen inhibitorok. Amennyiben a vérzés nem állítható el Önnél, illetve gyermekénél az ADYNOVI-val, azonnal tájékoztassa erről kezelőorvosát.
A vénakanülhöz kapcsolódó szövődmények
Ha centrális vénakanül szükséges, figyelembe kell venni a kanül alkalmazásához kapcsolódó szövődmények kockázatát, többek közt a helyi fertőzéseket, baktériumokat a vérben és a kanül helyén jelentkező trombózist.
Gyermekek és serdülők
Az ADYNOVI csak (12. életévüket betöltött) serdülőknél és felnőtteknél alkalmazható. A felsorolt figyelmeztetések és óvintézkedések a serdülőkre is vonatkoznak.
Egyéb gyógyszerek és az ADYNOVI
Feltétlenül tájékoztassa kezelőorvosát a jelenleg vagy nemrégiben alkalmazott, valamint alkalmazni tervezett egyéb gyógyszereiről.
Terhesség és szoptatás
Ha Ön terhes vagy szoptat, illetve ha fennáll Önnél a terhesség lehetősége vagy gyermeket szeretne, a gyógyszer alkalmazása előtt beszéljen kezelőorvosával. "A" típusú hemofília csak ritkán fordul elő nőknél. Ezért nem áll rendelkezésre tapasztalat az ADYNOVI terhesség és szoptatás alatt történő használatával kapcsolatosan.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
Az ADYNOVI nem befolyásolja a gépjárművezetéshez és a gépek kezeléséhez szükséges képességeket.
Az ADYNOVI nátriumot tartalmaz
A készítmény kevesebb mint 1 mmol (23 mg) nátriumot tartalmaz injekciós üvegenként, azaz gyakorlatilag "nátriummentes".
3. Hogyan kell alkalmazni az ADYNOVI-t?
Az ADYNOVI-kezelést olyan orvos fogja elkezdeni és felügyelni, aki tapasztalt az "A" típusú hemofíliában szenvedő betegek kezelésében.
Kezelőorvosa az Ön állapotától és testtömegétől, illetve attól függően, hogy megelőzésre vagy vérzés kezelésére fogják alkalmazni, kiszámítja az Ön ADYNOVI adagját. Az alkalmazás gyakorisága attól függ majd, hogy az ADYNOVI mennyire hatásos az Ön esetében. Általában az ADYNOVI-val végzett faktorpótló kezelést élete végéig kell folytatnia.
A gyógyszert mindig a kezelőorvosa által elmondottaknak megfelelően alkalmazza. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát.
Vérzés megelőzése
Az ADYNOVI szokásos adagja hetente 2-szer 40-50 NE testtömeg-kilogrammonként.
Vérzés kezelése
Az ADYNOVI adagját a testtömeg és az elérendő VIII-as faktorszint függvényében számítják ki. A VIII-as faktor célértéke a vérzés súlyosságától és helyétől függ.
Ha úgy gondolja, hogy az ADYNOVI hatása nem kielégítő, beszéljen kezelőorvosával. Kezelőorvosa a megfelelő laboratóriumi vizsgálatok segítségével ellenőrzi, hogy a VIII-as faktor szintje megfelelő-e. Ez különösen akkor fontos, ha komolyabb műtéten esik át.
Alkalmazása gyermekeknél és serdülőknél
Az ADYNOVI csak (12. életévüket betöltött) serdülőknél és felnőtteknél alkalmazható. Serdülők esetében is a testtömeg alapján számítják ki az adagot, és az adag megegyezik a felnőttekével.
Hogyan adják be Önnek az ADYNOVI-t?
Az ADYNOVI-t általában vénába fecskendezi be (intravénásan) kezelőorvosa vagy a gondozását végző egészségügyi szakember. Ön vagy valaki más is beadhatja az ADYNOVI-t injekcióként, de csak megfelelő képzés elvégzése után. Az öninjekciózás részletes utasításait a jelen betegtájékoztató végén találja.
Ha az előírtnál több ADYNOVI-t alkalmazott
Az ADYNOVI-t mindig a kezelőorvosa által elmondottaknak megfelelően alkalmazza. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát. Ha a javasoltnál több ADYNOVI-t fecskendezett be, minél előbb beszéljen kezelőorvosával.
Ha elfelejtette alkalmazni az ADYNOVI-t
Ne adjon be kétszeres adagot a kihagyott adag pótlására. A következő injekció az előírt adagolásnak megfelelően adja be, és folytassa a kezelőorvosa által előírt módon.
Ha idő előtt abbahagyja az ADYNOVI alkalmazását
Ne hagyja abba az ADYNOVI alkalmazását anélkül, hogy kezelőorvosával beszélt volna.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
Súlyos és hirtelen megjelenő allergiás (anafilaxiás) reakciók esetén azonnal le kell állítani az injekció adását. Ha az allergiás reakciók alábbi korai tüneteinek bármelyikét tapasztalja, azonnal forduljon kezelőorvosához:
- kiütés, csalánkiütés, testszerte jelentkező viszketés,
- az ajkak és a nyelv duzzanata,
- nehézlégzés, sípoló légzés, mellkasi szorító érzés,
- rossz közérzet,
- szédülés és eszméletvesztés.
A súlyos tünetek - többek közt a légzési nehézség és az ájulás (vagy ájuláshoz közeli állapot) - azonnali sürgősségi ellátást igényelnek.
A VIII-as faktor készítménnyel korábban már (legalább 150 napig) kezelt betegeknél nem gyakran (100 beteg közül kevesebb mint 1 esetben) gátló hatású ellenanyagok (inhibitor antitestek) jelenhetnek meg (lásd 2. pont). Ha bekövetkezik ez a szövődmény, előfordulhat, hogy a gyógyszer a továbbiakban nem fog hatni, és Ön tartós vérzést tapasztalhat. Ilyen esetben azonnal forduljon kezelőorvosához.
Nagyon gyakori mellékhatások (10 betegből több mint 1-nél jelentkezhet)
Fejfájás
Gyakori mellékhatások (10 betegből legfeljebb 1-nél jelentkezhet)
Hányinger
Hasmenés
Kiütés
Szédülés
Csalánkiütés
Nem gyakori mellékhatások (100 betegből legfeljebb 1-nél jelentkezhet)
Kipirulás, allergiás reakciók (túlérzékenység)
VIII-as faktor elleni inhibitorok (gátló anyagok) kialakulása (a VIII-as faktor készítménnyel korábban már (legalább 150 napig) kezelt betegeknél)
Bizonyos típusú fehérvérsejtek számának emelkedése
Infúziós reakció
Szemvörösség
A bőr nemkívánatos gyógyszerreakciója
További mellékhatások gyermekeknél
A mellékhatások gyakorisága, típusa és súlyossága gyermekeknél várhatóan megegyezik a felnőttekével.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa erről kezelőorvosát. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti a https://mellekhatas.ogyei.gov.hu/ weboldalon. A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell az ADYNOVI-t tárolni?
A gyógyszer gyermekektől elzárva tartandó!
A címkén és a dobozon feltüntetett lejárati idő (EXP) után ne alkalmazza ezt a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Hűtőszekrényben (2 °C - 8 °C) tárolandó.
Nem fagyasztható!
BAXJECT-et nem tartalmazó kiszerelés esetén:
A fénytől való védelem érdekében a buborékcsomagolást tartsa a dobozában.
A lejárati idő alatt a port tartalmazó injekciós üveg egyszeri alkalommal legfeljebb 3 hónapon át szobahőmérsékleten (legfeljebb 30 °C-on) tárolható. Ebben az esetben a gyógyszer lejárati ideje a 3 hónapos időszak vége vagy a készítmény injekciós üvegére nyomtatott lejárati idő, attól függően,
hogy melyik következik be korábban. A készítmény dobozára jegyezze fel a szobahőmérsékleten való 3 hónapos tárolási időszak végét. A készítmény a szobahőmérsékleten történt tárolás után nem helyezhető vissza hűtőszekrénybe. Az elkészített oldat hűtőszekrényben nem tárolható.
A por teljes feloldódása után 3 órán belül használja fel a készítményt.
A gyógyszer csak egyszeri alkalmazásra való. A fel nem használt oldatot az előírásoknak megfelelően kell megsemmisíteni.
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
BAXJECT-et tartalmazó kiszerelés esetén:
A fénytől való védelem érdekében az injekciós üveget tartsa a dobozában.
A lejárati idő alatt a port tartalmazó injekciós üveg egyszeri alkalommal legfeljebb 3 hónapon át szobahőmérsékleten (legfeljebb 30 °C-on) tárolható. Ebben az esetben a gyógyszer lejárati ideje a 3 hónapos időszak vége vagy a készítmény injekciós üvegére nyomtatott lejárati idő, attól függően, hogy melyik következik be korábban. A készítmény dobozára jegyezze fel a szobahőmérsékleten való 3 hónapos tárolási időszak végét. A készítmény a szobahőmérsékleten történt tárolás után nem helyezhető vissza hűtőszekrénybe. Az elkészített oldat hűtőszekrényben nem tárolható.
A por teljes feloldódása után 3 órán belül használja fel a készítményt.
A gyógyszer csak egyszeri alkalmazásra való. A fel nem használt oldatot az előírásoknak megfelelően kell megsemmisíteni.
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz az ADYNOVI?
- A készítmény hatóanyaga az alfa-rurioktokog pegol (rekombináns DNS technológiával előállított pegilált humán VIII-as véralvadási faktor). Minden injekciós üveg névlegesen 250, 500 vagy 1 000 NE alfa-rurioktokog pegolt tartalmaz.
- Az oldószeres injekciós üveg 2 ml, injekcióhoz való sterilizált vizet tartalmaz.
- Egyéb összetevők: mannit, trehalóz-dihidrát, hisztidin, glutation, nátrium-klorid, kalcium- klorid-dihidrát, trisz-(hidroximetil-)amino-metán, poliszorbát 80 és injekcióhoz való sterilizált víz. Az ADYNOVI nátriumot tartalmaz, lásd a 2. pontot.
Milyen az ADYNOVI külleme és mit tartalmaz a csomagolás?
Az ADYNOVI gyógyszerformája: por és oldószer oldatos injekcióhoz. A por fehér vagy törtfehér színű, könnyen porladó anyag. Az oldószer tiszta és színtelen oldat. Feloldás után az oldat átlátszó, színtelen és idegen részecskéktől mentes.
BAXJECT-et tartalmazó kiszerelés esetén:
Minden dobozban egy port tartalmazó injekciós üveg, egy oldószert tartalmazó injekciós üveg és a feloldáshoz szükséges eszköz (BAXJECT II Hi-Flow) található.
Az elkészítésre és beadásra vonatkozó utasítások BAXJECT-et nem tartalmazó kiszerelés esetén:
Az ADYNOVI nem keverhető más gyógyszerekkel vagy oldószerekkel.
Feltétlenül ajánlott minden egyes ADYNOVI-infúzió beadásakor feljegyezni a készítmény nevét és gyártási tételének számát. A buborékcsomagoláson lehúzható címkék találhatók.
A feloldásra vonatkozó utasítások
- A címkéken és a dobozon feltüntetett lejárati idő után ne alkalmazza.
- Ne használja, ha a fedél nem zárul teljesen a buborékcsomagolásra
- Az elkészített oldat hűtőszekrényben nem tárolható.
1. Ha a készítmény még a hűtőszekrényben van, vegye ki a lezárt buborékcsomagolást (amelyben a port és az oldószert tartalmazó injekciós üvegek a feloldáshoz szükséges rendszerrel előre összeszerelve találhatók) a hűtőszekrényből, és hagyja szobahőmérsékletűre (15 °C - 25 °C közé) melegedni.
2. Szappanos meleg vízzel alaposan mosson kezet.
3. A fedél lehúzásával nyissa ki az ADYNOVI buborékcsomagolását. Vegye ki a BAXJECT III rendszert a buborékcsomagolásból.
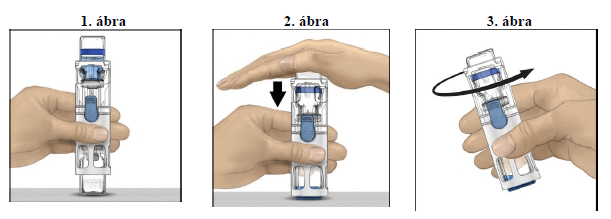
4. Helyezze a port tartalmazó injekciós üveget sík felületre úgy, hogy az oldószeres injekciós üveg van felül (1. ábra). Az oldószeres injekciós üvegen kék csík látható. Ne vegye le a kék kupakot addig, amíg egy későbbi lépésben azt az utasítást nem kapja.
5. Egyik kezével tartsa meg a BAXJECT III rendszerben lévő port tartalmazó injekciós üveget, a másik kezével pedig határozottan nyomja le az oldószert tartalmazó injekciós üveget, amíg mindkét injekciós üveg betolódik a rendszerbe, és az oldószer lefolyik a port tartalmazó injekciós üvegbe (2. ábra). Ne döntse meg a rendszert, amíg az oldószer teljesen át nem folyt.
6. Ellenőrizze, hogy az oldószer maradéktalanul átfolyt-e. Finoman mozgassa az injekciós üveget körbe-körbe, míg az összes por fel nem oldódik (3. ábra). Győződjön meg arról, hogy a por tökéletesen feloldódott, különben az eszköz szűrője nem engedi át az elkészített oldat teljes mennyiségét. A por gyorsan (általában 1 percen belül) feloldódik. Feloldás után az oldatnak átlátszónak, színtelennek és idegen részecskéktől mentesnek kell lennie.
Az injekció beadására vonatkozó utasítások
Az oldat elkészítése és beadása során aszeptikus (tiszta és csíraszegény) technikát kell alkalmazni.
Fontos megjegyzés:
- Beadás előtt szemrevételezéssel vizsgálja meg az elkészített oldatot, hogy nem tartalmaz-e szemcsés anyagot, vagy nincs-e elszíneződve (az oldatnak tisztának, színtelennek és részecskéktől mentesnek kell lennie).
Ne használja fel, ha az oldat nem teljesen tiszta, vagy nem oldódott fel teljesen.
1. Vegye le a BAXJECT III kék kupakját. Ne szívjon fel levegőt a fecskendőbe. Csatlakoztassa a fecskendőt a BAXJECT III eszközhöz. Luer-záras fecskendő használata javasolt.
2. Fordítsa meg a rendszert (most a port tartalmazó injekciós üveg van felül). Lassan húzza ki a dugattyút, így felszívja a feloldott készítményt a fecskendőbe.
3. Válassza le a fecskendőt, csatlakoztasson szárnyas tűt a fecskendőhöz, és adja be vénába a feloldott készítményt. Az oldatot lassan kell beadni, a beteg komfortszintje alapján meghatározott sebességgel, amely nem haladhatja meg a percenkénti 10 ml-t. (Lásd 4. pont, Lehetséges mellékhatások).
4. A fel nem használt oldatot az előírásoknak megfelelően kell megsemmisíteni.
Az elkészítésre és beadásra vonatkozó utasítások BAXJECT-et tartalmazó kiszerelés esetén:
Az oldat elkészítéséhez csak az ADYNOVI csomagjában mellékelt oldószert és feloldáshoz szükséges eszközt használja. A por nem keverhető más gyógyszerekkel vagy oldószerekkel, és nem használható más feloldó eszközökkel.
Feltétlenül ajánlott minden egyes ADYNOVI-infúzió beadásakor feljegyezni a készítmény nevét és gyártási tételének számát. A port tartalmazó injekciós üvegen lehúzható címkék találhatók.
A feloldásra vonatkozó utasítások
- A címkéken és a dobozon feltüntetett lejárati idő után ne alkalmazza.
- Ne használja a BAXJECT II Hi-Flow eszközt, ha annak steril védelmi rendszere vagy csomagolása sérült, illetve ha károsodás bármilyen jele látható rajta.
1. A feloldási eljárás során használjon aszeptikus (tiszta és csíraszegény) technikát és sima munkafelületet.
2. A por és az oldószer injekciós üvegét alkalmazás előtt hagyja szobahőmérsékletűre (15 °C - 25 °C közé) melegedni.
3. Vegye le a port és az oldószert tartalmazó injekciós üveg műanyag kupakját.
4. Egy alkoholos törlővel tisztítsa meg az injekciós üvegek gumidugóját, és felhasználás előtt hagyja megszáradni.
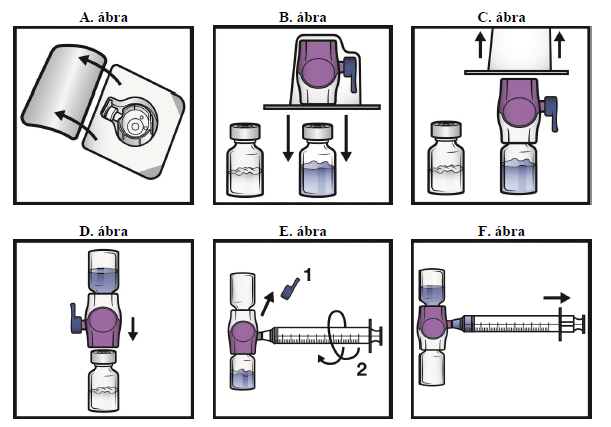
5. Bontsa fel a BAXJECT II Hi-Flow eszköz csomagolását a fedél lehúzásával úgy, hogy ne nyúljon a csomagolás belsejébe (A. ábra). Ne vegye ki az eszközt a csomagolásból!
6. Fordítsa meg a csomagolást. Egyenesen lefelé nyomva szúrja be az átlátszó műanyag tüskét az oldószeres injekciós üveg dugójába (B. ábra).
7. Pereménél fogva húzza le a csomagolást a BAXJECT II Hi-Flow eszközről (C. ábra). Ne vegye le a BAXJECT II Hi-Flow eszköz kék kupakját. Ne érintse meg a szabadon lévő lila műanyag tüskét.
8. Fordítsa meg a rendszert úgy, hogy az oldószeres injekciós üveg legyen felül. Egyenesen lefelé nyomva gyorsan szúrja a lila műanyag tüskét teljesen a port tartalmazó injekciós üveg dugójába (D. ábra). A kialakult vákuum miatt az oldószer átfolyik a port tartalmazó injekciós üvegbe.
9. Finoman mozgassa az injekciós üveget körbe-körbe, míg a por teljesen fel nem oldódik. Feloldás után nem tárolható hűtőszekrényben.
Az injekció beadására vonatkozó utasítások
Fontos megjegyzés:
- Beadás előtt szemrevételezéssel vizsgálja meg az elkészített oldatot, hogy nem tartalmaz-e szemcsés anyagot, vagy nincs-e elszíneződve (az oldatnak tisztának, színtelennek és részecskéktől mentesnek kell lennie).
Ne használja az ADYNOVI-t, ha az oldat nem teljesen tiszta, vagy nem oldódott fel teljesen.
1. Vegye le a BAXJECT II Hi-Flow eszköz kék kupakját (E. ábra). Ne szívjon fel levegőt a fecskendőbe. Csatlakoztassa a fecskendőt a BAXJECT II Hi-Flow eszközhöz. Luer-záras fecskendő használata javasolt.
2. Fordítsa meg a rendszert (most a port tartalmazó injekciós üveg van felül). Lassan húzza ki a dugattyút, így felszívja a feloldott készítményt a fecskendőbe (F. ábra).
3. Vegye le a fecskendőt, csatlakoztasson megfelelő tűt, és adja be intravénásan. Ha egy betegnek egynél több injekciós üvegnyi ADYNOVI-ra van szüksége, több injekciós üveg tartalma felszívható ugyanabba a fecskendőbe.
Külön BAXJECT II Hi-Flow eszköz szükséges minden egyes ADYNOVI injekciós üveg oldószerrel történő feloldásához.
4. Legfeljebb 5 perc alatt adja be (maximális infúziós sebesség 10 ml percenként).
5. A fel nem használt oldatot az előírásoknak megfelelően kell megsemmisíteni.